Belka und Strelka - Belka und Strelka erreichten ein hohes Alter und starben eines natürlichen Todes. Nach einiger Zeit bekam Strelka Welpen. Belka und Strelka gehörten zu den anpassungsfähigsten Kandidatenhunden. Am 19. August 1960 wurde ein Satellit erfolgreich in die Umlaufbahn gebracht. Alle sechs Welpen waren gesund.
Wenn Protonen an Hämoglobin binden, sinkt außerdem ihre Konzentration und der pH-Wert gleicht sich aus, sodass Hämoglobin eine Pufferkapazität zeigt, die hilft, den pH-Wert des Blutes aufrechtzuerhalten. Somit erkennt Hämoglobin auch den Sauerstoffbedarf jedes Gewebes.
Aus diesem Grund wird Hämoglobin als computergesteuertes Molekül bezeichnet, das in der Lage ist, den Sauerstoffbedarf jedes Gewebes in Abhängigkeit von seiner Aktivität zu erkennen und auf diesen Bedarf zu reagieren, indem es in jedem von ihnen die jeweils geeignete Menge an Sauerstoff freisetzt.
"Eichhörnchen-Lektion" - Qualitative Reaktionen. Allgemeine Eigenschaften Proteine. Quartärstruktur eines Proteinmoleküls. Biuret Xanthoprotein HNO3 NaOH CuSO4. Der Gehalt an Proteinen im Körper (in Prozent des Trockengewichts). Die Struktur des Proteinmoleküls. Eichhörnchen. Proteinfunktionen. Proteingehalt in Lebensmitteln. Was ist Leben?
Bei Erwachsenen hat Hämoglobin zwei Alpha-Ketten und zwei Beta-Ketten, aber während des fötalen Lebens ist Hämoglobin 2 Alpha-2-Gamma, es hat zwei Gamma-Ketten anstelle von zwei Beta-Ketten. Gamma-Untereinheiten liefern weniger positive Ladungen in jedem zentralen Hämoglobinkanal.
Wenn fötales und mütterliches Hämoglobin die gleiche Affinität zu Sauerstoff hätten, müssten sie darum konkurrieren, bis sie ein Gleichgewicht erreicht hätten. Glücklicherweise erleichtert dieser Unterschied in der Sauerstoffaffinität zwischen den beiden Hämoglobinen den Durchgang von Sauerstoff von der Mutter zum Fötus über die Plazenta-Blutschranke, wodurch das Baby mit Sauerstoff versorgt wird.
"Proteinbiosynthese" - Essentielle Aminosäuren sind fett dargestellt. Teilnehmer an der Biosynthese von Proteinmolekülen. Falsche Antwort. Inhalt. Überprüfen Sie sich. Schema von Gemüse und tierische Zellen. Einführung. Korrekte Antwort. Biosynthese von Proteinen in einer lebenden Zelle. Der Prozess der Proteinbiosynthese in einer lebenden Zelle. Energielieferanten für die Proteinbiosynthese.
Gluten besteht hauptsächlich aus Proteinen. Ein Protein ist ein Molekül, das aus einer Reihe von Aminosäuren besteht. Eine Aminosäure ist ein organisches Molekül. Aminosäuren sind wichtig: Einige von ihnen haben ihren eigenen Geschmack, beeinflussen die Struktur und das Verhalten des Proteins, zu dem sie gehören, und sind an Röstreaktionen beteiligt, die Wärme verleihen. Vergebung, ja, kommt von „braun“, etwa wenn eine Masse Weißbrot in den Ofen kommt und eine braune und goldene Kruste bildet oder karamellisierter Zucker: Das Toasten verleiht dem Brot etwas.
Gluten könnte laut Harold McGee die größten Proteinmoleküle haben, die wir in der Natur finden können. Gluten ist eine komplexe Mischung aus bestimmten Weizenproteinen, die in Wasser unlöslich sind, aber an Wassermolekülen und aneinander haften.
"Proteinchemie" - Die Zusammensetzung von Schleim und Synovialflüssigkeit umfasst Mukoproteine. Definition. Die Struktur der Polypeptidkette. Inhalt. Alle Verbindungen, die eine Peptidbindung enthalten, ergeben eine solche Reaktion. Sequenzielle Verknüpfung von Aminosäuren zur Bildung eines Proteinmoleküls. Die Primärstruktur des Proteins bleibt während der Denaturierung erhalten.
Dies sind die Stärken und Lipide des Mehls, die dem Brot zusammen mit den im Mehl vorhandenen Bakterien und Enzymen Geschmack verleihen oder Hefe oder Hefe enthalten. Gluten hat zwei Hauptproteine: Gliadine und Gliadine. Die Gliadinketten biegen sich um und bilden schwache Bindungen zwischen ihnen und den Gluteninen. Es ist eine klebrige Substanz, die es dem Gluten ermöglicht, eine bindende Verbindung zu bilden, und hilft, den Teig klebrig und leicht zu verteilen. Variationen in den Glutenineigenschaften sind für die meisten Unterschiede zwischen verschiedenen Weizenmehlsorten verantwortlich.
"Proteine und ihre Funktionen" - Die Funktionen von Proteinen sind äußerst vielfältig. Baumaterial. Kontraktile Proteine verursachen alle Bewegungen. Chemische Eigenschaften Proteine. Herstellung von Eiweißkörpern und Antikörpern zur Neutralisierung von Fremdstoffen. Proteinfunktionen. Aus Proteinen aufgebaut Blutgefäße, Sehnen, Haare. Sekundärstruktur Tertiärstruktur Quartärstruktur.
Die Ketten stellen untereinander mehrere Verbindungen her und bilden ein kompaktes und verzweigtes Netzwerk. An den Enden von Glutenketten befinden sich schwefelhaltige Aminosäuren, die starke Bindungen miteinander eingehen können, aber dafür Sauerstoff aus der Luft und einige Substanzen benötigt werden, die Hefe enthält. Glutenin verleiht der Masse Elastizität und Festigkeit. Dies trägt zur Entwicklung der Massenstruktur bei.
Das heißt, Gliadin verleiht Dehnbarkeit und Glutenin Elastizität. Dies bewirkt, dass der Teig dem Dehnen und Dehnen der Reihe nach standhält, ohne zu brechen. Weizenmehlgluten zeichnet sich durch seine Elastizität und Plastizität aus. Es ändert seine Form, wenn es gedrückt wird, stellt aber seine ursprüngliche Form wieder her, wenn es nicht gedrückt wird. Die Elastizität ist auf das Vorhandensein von Gliadinproteinen unter den Gluteninen zurückzuführen und ist ein Ergebnis der helikalen und helikalen Struktur der miteinander verbundenen Glutenproteine. Durch das Kneten werden die Proteinmoleküle abgewickelt und ausgerichtet, aber es gibt immer Falten und Faltungen entlang dieser Moleküle.
"Aminosäuren und Proteine" - Reaktionen von ?-Aminosäuren. Biuret-Reaktion (mit Kupfer(II)-hydroxid Cu(OH) 2) Ninhydrin-Reaktion. VERSCHIEDENE VERSIONEN DES BILDES DER STRUKTUR DES CRUMBIN-PROTEINS. Abfall mit optisch aktivem Isomer einer a-Aminosäure. BILDUNG INTRAMOLEKULÄRER WASSERSTOFFVERBINDUNGEN (gestrichelt dargestellt) in einem Polypeptidmolekül.
Wenn wir die Masse dehnen, wickeln wir diese Falten ab, aber wenn wir aufhören zu dehnen, neigen die Moleküle dazu, in ihre ursprüngliche Form zurückzukehren. Diese Elastizität lässt mit der Zeit nach: Brot braucht Zeit und Geduld, denn diese Entspannung ermöglicht es uns, das Brot zu formen.
In Weizenmehl fängt Gluten das Kohlendioxid ein, das die Hefe während der Fermentation freisetzt, und dies gibt uns ein Brot mit guter Masse sowie eines, das zur Krumenstruktur beiträgt. In Roggenmehl machen glutenähnliche Proteine den Teig klebrig, aber ohne die Elastizität oder Dehnbarkeit von Weizenteig. Deshalb wird kompakteres Brot ausgegeben. Roggenmehl enthält auch Gliadin und Glutenin, aber aufgrund der Anwesenheit von Pentosanen sind seine Eigenschaften unterschiedlich. Es ist zu beachten, dass Gluten während der Fermentation Gase zurückhalten kann, was zum Wachstum von Brot führt.
>> Artikel >>
Proteindenaturierung
Berezov T.T., Korovkin B.F.
Natürliche Proteinkörper sind mit einer bestimmten, genau definierten räumlichen Konfiguration ausgestattet und haben eine Reihe charakteristischer physikalisch-chemischer und biologischer Eigenschaften bei physiologischen Temperaturen und pH-Werten. Unter dem Einfluss verschiedener physikalischer und chemischer Faktoren koagulieren und präzipitieren Proteine, wobei sie ihre natürlichen Eigenschaften verlieren. Daher sollte die Denaturierung als Verletzung des allgemeinen Plans der einzigartigen Struktur des nativen Proteinmoleküls, hauptsächlich seiner Tertiärstruktur, verstanden werden, die zum Verlust seiner charakteristischen Eigenschaften (Löslichkeit, elektrophoretische Mobilität, biologische Aktivität usw.) führt. Die meisten Proteine denaturieren, wenn ihre Lösungen auf über 50–60 °C erhitzt werden.
Deshalb ergeben glutenfreie Cerealien weniger fluffige Massen. Starkes Gluten eignet sich hervorragend für Brot. Deshalb gibt es Methoden und Zutaten, die es dem Bäcker ermöglichen, die Festigkeit des Glutens zu kontrollieren. Es gibt eiweißreiche wie Stärke- oder Backwaren und eiweißarme wie Backmehl. Das Vorhandensein von Oxidationsmitteln im Mehl, wie eine Art chemischer Verbesserungsstoff, verleiht der Masse viel Masse. Auch der Anteil des Wassers, der Masse enthält, wird beeinflusst. Mit etwas Wasser entwickelt sich überhaupt kein Gluten und der Teig krümelt. Mit mehr Wasser erhalten Sie etwas konzentriertes Gluten und Teig und Brot werden weicher und saftiger. kneten. Durch die Arbeit und das Rühren der Mehl-Wasser-Mischung bilden die Glutenproteine eine elastische Masse. Zucker. - Zucker schränkt die Bildung von Gluten ein, da er Mehlproteine verdünnt. Fette schwächen Gluten, weil sie an hydrophobe Aminosäuren binden und deren Bindung verhindern. Die Säure der Masse. Die Säure des Teigs schwächt auch das Haftnetz.
- Art von Mehl.
- Oxidationsmittel.
Äußere Manifestationen der Denaturierung werden auf einen Löslichkeitsverlust, insbesondere am isoelektrischen Punkt, eine Zunahme der Viskosität von Proteinlösungen, eine Zunahme der Anzahl freier funktioneller SH-Gruppen und eine Änderung der Art der Röntgenstreuung reduziert . Das charakteristischste Zeichen der Denaturierung ist eine starke Abnahme oder ein vollständiger Verlust der biologischen Aktivität (katalytisch, antigen oder hormonell) des Proteins. Bei der Proteindenaturierung durch 8 M Harnstoff oder andere Mittel werden meist nicht-kovalente Bindungen (insbesondere hydrophobe Wechselwirkungen und Wasserstoffbrückenbindungen) zerstört. Disulfidbindungen werden in Gegenwart des Reduktionsmittels Mercaptoethanol aufgebrochen, während die Peptidbindungen des Rückgrats der Polypeptidkette selbst nicht angegriffen werden. Unter diesen Bedingungen entfalten sich Kügelchen aus nativen Proteinmolekülen und es entstehen zufällige und ungeordnete Strukturen (Abb. 1.12).
Außerdem hat jedes Müsli eine andere Menge. Normale Sache: Je höher der Proteingehalt, desto später entwickelt sich das Gluten. Eine Methode, um die Knetzeit zu verkürzen, besteht darin, Mehl einige Minuten lang mit Wasser zu mischen. Diese Methode wurde von Raymond Calvel erfunden. Während der Ruhezeit beginnen Proteinmoleküle zu binden. Dann erneut kneten und es dauert weitere 2-4 Minuten, bis der gesamte Vorgang abgeschlossen ist. Auge: Wir sprechen über das Mischen von Mehl und Wasser. Ohne Salz, weil es im Gluten Steifheit verursacht und ohne Hefe, weil dann Gärung stattfindet und die Masse im Überschuss festigt.
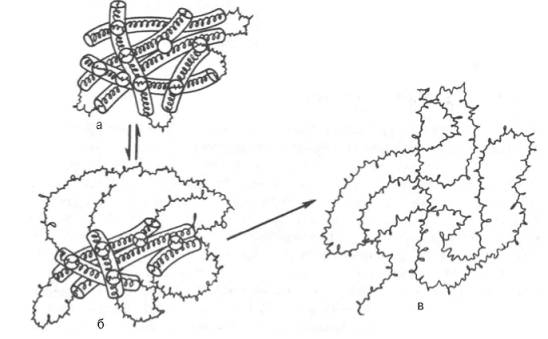
Reis. 1.12. Denaturierung eines Proteinmoleküls (Schema).
a - Anfangszustand; b - beginnende reversible Verletzung der Molekülstruktur; c - irreversibler Einsatz der Polypeptidkette.
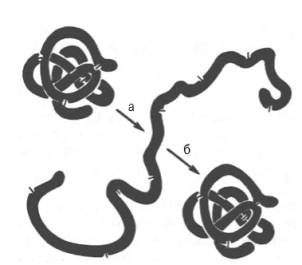
Reis. 1.13. Denaturierung und Renaturierung der Ribonuklease (nach Anfinsen).
Woher wissen wir, ob sich Gluten entwickelt hat? Es gibt einen Test namens Membrantest. Schneiden Sie ein Stück Teig aus und dehnen Sie es vorsichtig, bis es wie eine Membran ist, transparent und glatt, als wäre es die Haut einer Trommel. Wenn sich der Teig öffnet, ist er noch nicht fertig, also noch ein paar Minuten kneten und den Test wiederholen.
Scheuen Sie sich nicht, durchzugehen, denn es ist sehr schwierig, den Teig zu kneten, es sei denn, Sie haben leistungsstarke Industriegeräte oder Kneter. Wenn die Membran sehr, sehr glatt ist, können Sie verstopft sein. Aber beim Kneten von Hand ist es wie versprochen knifflig. Da der chirurgische Eingriff zwangsläufig organisches Gewebe schneidet und beschädigt, entstehen Kontinuitätslösungen im Gefäßsystem, manchmal auf der Ebene der Makrozirkulation und immer in der Mikrozirkulation.
a - Bereitstellung (Harnstoff + Mercaptoethanol); b - Rückfaltung.
Bei kurzer Einwirkung und schneller Entfernung von Denaturierungsmitteln ist eine Proteinrenaturierung unter vollständiger Wiederherstellung der ursprünglichen dreidimensionalen Struktur und der nativen Eigenschaften seines Moleküls (Abb. 1.13) einschließlich der biologischen Aktivität möglich. Somit verliert ein Proteinmolekül bei Denaturierung vollständig seine biologischen Eigenschaften, was eine enge Beziehung zwischen Struktur und Funktion demonstriert. Aus praktischen Gründen wird das Denaturierungsverfahren manchmal unter "milden" Bedingungen verwendet, beispielsweise bei der Herstellung von Enzymen oder anderen biologisch aktiven Proteinpräparaten bei niedrigen Temperaturen in Gegenwart von Salzen und bei einem geeigneten pH-Wert. Wenn Proteine lyophilisiert werden (Trocknen im Vakuum durch Sublimation von Feuchtigkeit aus einem gefrorenen Zustand), werden häufig Chemikalien (Einfachzucker, Glycerin, organische Anionen) verwendet, um eine Denaturierung zu verhindern.
Die Folge ist eine operative Blutung, d. h. ein Blutfluss außerhalb des Gefäßsystems, sei es arteriell oder venös, und die aus diesen Blutungen resultierenden allgemeinen Phänomene, wenn sie unkontrolliert eine bestimmte Grenze überschreiten, sind bereits bekannt: Hypovolämie und Gewebemangeldurchblutung, die einen Zustand des hämorrhagischen Schocks erreichen können.
Basierend auf diesen ersten Überlegungen wurde es gegeben sehr wichtig für den Zahn- und Kieferchirurgen eine genaue Kenntnis der Hämostase in einem sehr weiten Sinne, d. h. einer Reihe von biologischen Prozessen und technischen Verfahren, die dazu dienen, Blutungen zu stoppen und zu kontrollieren.
Referenzliste
Für die Vorbereitung dieser Arbeit wurden Materialien von der Website verwendet.http://www.xumuk.ru/
Ähnliche Arbeiten:
- Zusammenfassung >>
Ketten werden gebildet -S-S-Bindungen. Denaturierung Eichhörnchen. Je höher der Organisationsgrad Eichhörnchen, je schwächer die Anhänger ... . Verletzung der nativen einzigartigen Struktur Eichhörnchen genannt Denaturierung. Grad Denaturierung Eichhörnchen kommt auf die intensität an...
Die Hämostase kann in ihrem spontanen oder natürlichen Aspekt oder in Bezug auf die Operationstechnik betrachtet werden. Spontane oder natürliche Hämostase kann als eine Reihe präzise integrierter biologischer Prozesse definiert werden, deren Zweck es ist, das Blut im Gefäßsystem aufrechtzuerhalten und die in den Gefäßen auftretenden Kontinuitätsentscheidungen zu beseitigen. Die chirurgische Blutstillung vereint alle technischen Verfahren, die der Chirurg anwendet, um versehentlich oder während einer Operation auftretende Blutungen zu kontrollieren.
Bei allen chirurgischen Eingriffen sind zwei Formen der Blutstillung notwendig, um die Blutung zu kontrollieren, da beim Verschluss makroskopischer Gefäße durch chirurgische Blutstillungstechniken die natürliche oder spontane Blutstillung vorzugsweise die Blutung stoppt, die in der ausgedehnten Mikrozirkulation der Verwundeten im Operationsgebiet auftritt.
