مجمع الآليات التي تحافظ على الدم الحالة السائلة، بدون تخثره في تجويف الوعاء الدموي أو تسربه عبر جدار الأوعية الدموية ، يسمى الإرقاء. نظرًا لأنه يتم التعامل مع الحالات المرضية المرتبطة بتخثر الدم في المحاضرة التالية ، يجب مراعاة التغييرات الأخرى المرتبطة بضعف الإرقاء هنا.
النزيف (النزف ، من الكلمة اليونانية haima - الدم و rhein - للتدفق) هو خروج الدم من السرير الوعائي أو القلب إلى بيئة(نزيف خارجي) أو في تجويف الجسم تجويف عضو مجوف (نزيف داخلي). أمثلة على النزيف الخارجي هي النزيف الرحمي (الرحم) ، ميلينا (الأمعاء) ، والداخلي - hemopericardium ، hemothorax ، hemoperitoneum and hemarthrosis (في تجويف التامور ، غشاء الجنب ، تجويف البطن أو المفصل ، على التوالي).
اعتمادًا على مصدر النزيف ، يتم تقسيمها إلى شرياني ، وريدي ، وريدي شرياني (مختلط) ، وشعري ، ومتني (شعري من أعضاء متني) وقلب.
نوع معين من النزيف هو النزيف ، حيث يتراكم الدم خارج الأوعية الدموية في الأنسجة. هناك أربعة أنواع منه:
ورم دموي - نزيف مع انتهاك لسلامة الأنسجة وتشكيل تجويف.
التشريب النزفي (تسلل) - نزيف مع الحفاظ على سلامة الأنسجة ؛
كدمة (كدمة) - نزيف مستو في الجلد والأنسجة تحت الجلد والأغشية المخاطية.
نمشات - نزيف نقطي في الجلد والأغشية المخاطية والأغشية المصلية ، اعضاء داخلية.
يُطلق على النزيف النقطي المتعدد ، الذي يندمج في نزيف أكبر ، فرفرية نزفية ، وتسمى الكدمة التي يصل قطرها إلى 2 سم بالكدمات.
تشمل آليات تطور كل من النزيف والنزيف ما يلي:
تمزق (hemorragia per rhexin) ، ناتج عن إصابات في وعاء غير متغير أو نخر (تمزق القلب في احتشاء عضلة القلب) ، والتهاب (التهاب الوعاء الزهري مع تمزق الأبهر) ، وتمدد الأوعية الدموية في جدار الأوعية الدموية المصاب ؛
تآكل (هيموراغيا لكل ديابروزين) ، أو نزيف تآكل يتطور عندما يتلف جدار الأوعية الدموية بسبب الالتهاب (صديدي عادة) ، ورم خبيث ، نخر (نخر جبني في كهف نزيف السل) ، التعرض للمواد الكيميائية (عصير المعدة يمكن أن يسبب نزيف من قرحة في المعدة) ، إنبات الزغابات المشيمية لأوعية قناة فالوب أثناء الحمل خارج الرحم ؛
ديابديسيس (haemorragia per diapedesin ، من اليونانية. dia - through، pedao - jump) ، يتميز بإفراز الدم بسبب زيادة نفاذية الأوعية الدموية ، كقاعدة عامة ، الأوعية السليمة في قاع الدورة الدموية الدقيقة أثناء نقص الأكسجة الحاد ، والتسمم ، والعدوى ، تجلط الدم المختلفة ، أهبة النزفية. في كثير من الأحيان ، يتطور نزيف السكري مع أزمة ارتفاع ضغط الدم والتهاب الأوعية الدموية وسرطان الدم والهيموفيليا والبوليون في الدم.
الميل للنزيف أو النزيف العفوي استجابة لأضرار طفيفة يسمى أهبة النزفية. ترتبط هذه الحالة بالتغيرات النوعية أو الكمية في الصفائح الدموية ، أو قصور تخثر الدم ، أو الهشاشة المرضية أو زيادة نفاذية جدار الأوعية الدموية ، سواء كانت وراثية أو مكتسبة.
الأسباب الرئيسية للنزيف هي:
1. لوحظ زيادة هشاشة جدار الأوعية الدموية مع عيوبها الخلقية والالتهابات والتسمم ، ونقص البري بري ، والعلاج بالستيرويد.
2. عيوب الصفائح الدموية. وتشمل قلة الصفيحات من أي أصل ، ضعف الالتصاق الوراثي أو المكتسب (مرض فون ويلبراند ، مرض برنارد سولييه ، أهبة النزف الوراثي ، إلخ) ، ضعف التجميع أو انخفاض في إفراز الصفائح الدموية ؛
3. عدم كفاية عوامل التخثر الخلقية (الهيموفيليا A للعامل الثامن ، الهيموفيليا B للعامل التاسع ، مرض فون ويلبراند ، عوامل تخثر الدم الأخرى) أو الأصل المكتسب في كثير من الأحيان (مع أمراض الكبد ، نقص فيتامين K ، بعض الآفات المناعية) ؛
4. التخثر المفرط داخل الأوعية ، على سبيل المثال ، في التخثر المنتشر داخل الأوعية - DIC (انظر المحاضرة التالية).
يمكن أن تكون نتيجة النزيف مواتية (ارتشاف الدم المتدفق ، التنظيم ، التغليف ، تكوين كيس "صدئ") وغير موات (تقيح عند الإصابة بالعدوى).
ترجع قيمة النزيف إلى نوعه وشدته ومدته. وبالتالي ، يؤدي تمزق القلب أثناء احتشاء عضلة القلب مع تكون الدم إلى وفاة المريض بسرعة ، على الرغم من أن إجمالي كمية الدم المتدفقة لا تزيد عادة عن 100-200 جم. مع النزيف الشرياني وفقدان الدم بشكل كبير وفقر الدم الحاد مع نتيجة قاتلة يمكن أن تتطور. يؤدي النزيف الخفيف المطول من قرحة المعدة أو الاثني عشر المزمنة إلى فقر الدم المزمن التالي للنزف. تعتمد قيمة النزف ، أولاً وقبل كل شيء ، على توطينه وبعد ذلك فقط على حجمه. حتى النزيف البسيط في الدماغ يمكن أن يتسبب في تلف المراكز الحيوية وتورم الدماغ وموت المريض ، في حين أن النزيف الهائل غير المعقد في الأنسجة تحت الجلد لا يشكل خطرًا على الحياة.
غزارة البلازما - الخروج من تجويف وعاء بلازما الدم مع تشريب الأنسجة المحيطة (تشريب البلازما) بسبب زيادة نفاذية الأوعية الدموية. تحدث غزارة البلازما عبر البطانة بسبب الترشيح الفائق (خروج البلازما عبر مسام الغشاء القاعدي للبطانة بسبب زيادة الضغط الهيدروستاتيكي أو التناضحي) ، والانتشار (بسبب انحدار مكونات البلازما في التجويف وخارجه) ، والنقل الميكروي للحويصلات (كثرة الخلايا الصغرى أو السيتوبميس ، والذي يحدث بسبب نشاط الأنظمة الأنزيمية للخلايا البطانية). من الممكن أيضًا التدفق الداخلي للخارج للبلازما. وبالتالي ، يتم تحديد غزارة البلازما من خلال تلف جدار الأوعية الدموية (بشكل أساسي البطانية) والتغيرات في ثوابت الدم. في الفحص المورفولوجي ، يثخن جدار أوعية الأوعية الدموية الدقيقة ، ويصبح متجانسًا ، وعند الفحص المجهري الإلكتروني ، تظهر الخلايا البطانية المنتفخة عددًا كبيرًا من الحويصلات الدقيقة ، وتشكيل الفجوات والأنفاق ، وظهور فجوات بين الخلايا ، وتفكك الغشاء القاعدي من البطانة. يؤدي تراكم مكونات البلازما إلى تلف الخلايا والمواد بين الخلايا في كل من جدار الأوعية الدموية والأنسجة المحيطة بالأوعية الدموية ، مما يؤدي إلى الإصابة بالتهاب الأوعية الدموية ، وفي الحالات الشديدة ، نخر الفيبرينويد.
الصدمة هي حالة مرضية شديدة تتميز بانهيار الدورة الدموية (فشل الدورة الدموية الحاد) بعد تأثير قوي للغاية على الإرقاء. هناك أنواع من الصدمة نقص حجم الدم والقلب والتفسخ والأوعية الدموية.
تحدث صدمة نقص حجم الدم نتيجة لانخفاض سريع بنسبة 20٪ أو أكثر في حجم الدورة الدموية ، وهو ما يُلاحظ في فقدان الدم الحاد والجفاف. وبالتالي ، فإن فقدان السوائل والشوارد ممكن مع الحروق الشديدة (بسبب إطلاق البلازما من الأوعية الدموية الدقيقة التالفة) ، مع القيء الشديد والإسهال الغزير.
تتطور الصدمة القلبية استجابة لانخفاض حجم السكتة الدماغية في حالة تلف القلب ، والتي لوحظت في احتشاء عضلة القلب ، والتهاب عضلة القلب الحاد ، والقصور التاجي أو الأبهر الحاد ، وتجلط الصمام الاصطناعي ، وتمزق الحاجز بين البطينين ، ونقص الدم في قميص القلب. يؤدي الانخفاض الواضح في ضغط الدم إلى انخفاض كبير في إمدادات الدم من الأنسجة ، على غرار تغيرات نقص حجم الدم.
تحدث الصدمة الإنتانية (المعدية السامة) عندما يكون هناك عدوى ناجمة عن البكتيريا سالبة الجرام (E. coli ، Proteus ، Klebsiella ، إلخ) أقل في كثير من الأحيان موجبة الجرام (العنقوديات ، العقدية ، المكورات الرئوية). السموم المنبعثة (بشكل أساسي السموم الداخلية) تنشط أنظمة التكملة والتخثر وانحلال الفيبرين وكذلك الصفائح الدموية والعدلات. نتيجة لذلك ، يتم تحفيز تكوين أكسيد النيتريك (موسع وعائي قوي) ، عامل نخر الورم أ ، الإنترلوكينات ، التي تسبب فشل الدورة الدموية الحاد.
الصدمة الوعائية (إعادة التوزيع) يمكن أن تكون عصبية (مؤلمة ، مؤلمة ، مع إصابة الحبل الشوكي ، كمضاعفات التخدير) أو تأقية ، ناجمة عن تفاعلات فرط الحساسية المعممة. بسبب توسع الأوعية الواضح ، وزيادة نفاذية الشعيرات الدموية والإفرازات الشريانية الوريدية ، يحدث إعادة توزيع لحجم الدم داخل الأوعية الدموية ، مصحوبًا بانخفاض كبير في مقاومة الأوعية الدموية الطرفية الكلية.
الصدمة في تطورها تمر بثلاث مراحل:
1. تتميز المرحلة غير التقدمية (المبكرة) من الصدمة بانخفاض ضغط الدم والناتج القلبي ، مع الحفاظ على إمداد الدم الطبيعي نسبيًا للأعضاء الحيوية. يحدث هذا بسبب تضيق الأوعية الدموية التعويضي ، وخاصة الجلد والأمعاء. مع استنفاد آليات التكيف ، تمر الصدمة إلى المرحلة التالية ؛
2. تتميز المرحلة التدريجية من الصدمة بأعراض إكلينيكية شديدة ، وانهيار عميق بسبب نقص إمداد الدم إلى جميع الأعضاء والأنسجة (نقص تدفق الدم للأنسجة بسبب زيادة توسع الشرايين) ، وتطور اضطرابات التمثيل الغذائي والدورة الدموية. 3. في مرحلة الصدمة التي لا رجعة فيها ، لوحظ قصور حاد في الدورة الدموية على مستوى سرير الدورة الدموية الدقيقة مع انتهاك سلامة جدار الأوعية الدموية ، مما يؤدي إلى زيادة فشل الأعضاء المتعددة بسرعة ، وينتهي بموت المريض.
يكشف الفحص المورفولوجي عن تغيرات ضمور ونخرية معممة ، وظاهرة مدينة دبي للإنترنت (نزيف نمري ، ركود ، جلطات دموية في الأوعية الدموية الدقيقة). بالإضافة إلى ذلك ، نظرًا لخصائص بنية وعمل الأعضاء المختلفة ، تحدث تغيرات غريبة في كل منها - أجهزة الصدمة. وهكذا ، تتميز الكلية الصدمية بتطور نخر نخر (نخر في ظهارة الأنابيب الملتوية). تتجلى صدمة الرئة من خلال بؤر انخماص الرئة ، وذمة نزفية مصلية ، وأحيانًا مع فقدان خيوط الفيبرين (أغشية الهيالين). يحدث الاعتلال الدماغي الإقفاري في الدماغ ، ويتجلى في الوذمة والنزيف النقطي وبؤر النخر. في القلب ، لوحظت بؤر صغيرة في الغالب تحت الشغاف للنزيف ونخر عضلة القلب ، تنكس دهني لخلايا عضلة القلب مع ظواهر إعادة ارتدادها. في الطبقة القشرية من الغدد الكظرية ، هناك انخفاض يصل إلى الاختفاء التام للدهون المستخدمة في تخليق هرمونات الستيرويد. في الجهاز الهضمي ، تم العثور على نزيف وتقرحات وتقرحات حادة في الغشاء المخاطي. يتميز الكبد الصدمي بالتنكس الدهني لخلايا الكبد ، وفي بعض الحالات حتى نخر الفصيص المركزي.
يعتمد تشخيص الصدمة على نوعها وشدتها ومرحلة بدء العلاج ووجود المضاعفات. حاليًا ، في حالة الصدمة القلبية أو الصدمة الإنتانية الشديدة ، تصل نسبة الوفيات إلى 50٪ أو أكثر.
تحدد حالة نظام الإرقاء مسار ونتائج الحمل للأم والجنين. في السنوات الأخيرة ، كان هناك عدد كبير من المنشورات التي تشير إلى دور كبير لمضاعفات التهاب الوريد في الإجهاض المتكرر ، وموت الجنين داخل الرحم ، وانفصال المشيمة ، وتطور الارتعاج ، وتأخر النمو داخل الرحم.
الآليات الأساسية للإرقاء
نظام الإرقاء أو نظام تنظيم تراكم الدم (PACK) هو نظام بيولوجي ينظم حالة تجمع الدم ويحافظ على القدرة المرقئة اللازمة للجسم. نظام PACK مبلط ، أي إمكانات مرقئ في أجزاء مختلفة من تدفق الدم ليست هي نفسها. هذه الحالة طبيعية لـ نظام وظيفي. يشمل نظام تنظيم الحالة الكلية للدم ما يلي:
- الأعضاء المركزية للنظام - نخاع العظام والكبد والطحال.
- التكوينات المحيطية - الخلايا البدينة وبطانة الرحم وطبقات أخرى من جدار الأوعية الدموية وخلايا الدم ؛
- الأنظمة التنظيمية المحلية - نباتي الجهاز العصبي، الهياكل تحت القشرية.
يتم تنظيم نظام الإرقاء بواسطة آليات عصبية عصبية معقدة. تخلق هذه الآليات ظروفًا لا تنتقل فيها عملية التخثر التي بدأت محليًا ، والتي تعد ضرورية لوقف النزيف ، إلى عملية التخثر العام داخل الأوعية أثناء الأداء الطبيعي للنظام.
هناك أربعة روابط رئيسية في نظام الإرقاء:
- ارتباط الأوعية الدموية بالصفائح الدموية.
- عوامل التجلط.
- رابط فبريناليتيك
- رابط لمثبطات تخثر الدم.
ارتباط الأوعية الدموية بالصفائح الدموية
غالبًا ما يشار إلى رابط الأوعية الدموية بالصفائح الدموية لنظام الإرقاء على أنه الإرقاء الأولي. البطانة الأوعية الدمويةيلعب دور مهمفي الحفاظ على حالة تجمع الدم المنتشر. هذا يرجع إلى الميزات التالية:
- القدرة على تكوين وإطلاق مثبط قوي لتراكم الصفائح الدموية في الدم - البروستاسكلين (مستقلب حمض الأراكيدونيك) ؛
- إنتاج منشط انحلال الفبرين في الأنسجة ؛
- عدم القدرة على الاتصال بتفعيل نظام تخثر الدم ؛
- خلق إمكانات مضادة للتخثر في واجهة الدم / الأنسجة عن طريق تثبيت مركب الهيبارين-مضاد الثرومبين III على البطانة ؛
- القدرة على إزالة عوامل التخثر المنشطة من مجرى الدم.
يتم تحديد مشاركة الصفائح الدموية في الإرقاء من خلال قدرتها على الالتصاق بموقع الإصابة البطانية ، وعملية تجميعها وتشكيل سدادة الصفائح الدموية الأولية ، وكذلك قدرتها على الحفاظ على تشنج الأوعية الدموية عن طريق إفراز المواد الفعالة في الأوعية - الأدرينالين ، النوربينفرين ، السيروتونين ، ADP ، وما إلى ذلك ، وكذلك لتكوين وتراكم وإفراز المواد التي تحفز الالتصاق والتجمع.
وهكذا ، أدت العديد من الدراسات إلى استنتاج مفاده أن الإرقاء الأولي يتم بشكل رئيسي عن طريق الصفائح الدموية ، وليس عن طريق تخثر الدم. الدور الرائد في تنفيذ الإرقاء الأولي ينتمي إلى وظيفة التجميع اللاصق للصفائح الدموية.
التصاق - التصاق الصفائح الدموية بموقع تلف جدار الأوعية الدموية ، بألياف الكولاجين في جدار الأوعية الدموية ، بالميكروفيبرين والإيلاستين. أهم العوامل المساعدة للبلازما في هذه العملية هي أيونات الكالسيوم والبروتين المركب في البطانة - عامل فون ويلبراند والبروتينات السكرية لغشاء الصفائح الدموية. الغرض الفسيولوجي من الالتصاق هو سد خلل في جدار الأوعية الدموية. بالتزامن مع الالتصاق ، يحدث تراكم الصفائح الدموية. في هذه الحالة ، لا تلتصق الصفائح الدموية ببعضها البعض فحسب ، بل تلتصق أيضًا بالصفائح الدموية الملتصقة ، بسبب تكوين سدادة مرقئ. في عملية الالتصاق والتجمع ، تفرز الصفائح الدموية بنشاط حبيبات تحتوي على مواد تعزز عملية التجميع وتشكل موجتها الثانية. تفاعل إطلاق عوامل الصفيحات - ADP ، الأدرينالين ، النوربينفرين ، السيروتونين ، عامل مضاد الهيبارين ، بيتا ثرومبوجلوبولين ، إلخ. لاحقًا ، يتم إفراز الحبيبات التي تحتوي على إنزيمات الليزوزومات (تفاعل الإطلاق الثاني). لا يؤدي إطلاق الأدرينالين والنورادرينالين والسيروتونين إلى تعزيز التراكم فحسب ، بل يساهم أيضًا في حدوث تشنج ثانوي في الأوعية الدموية ، والذي يصاحبه تثبيت موثوق لسدادة الصفائح الدموية في موقع تلف الوعاء الدموي. نتيجة للتفاعل بين عوامل الصفائح الدموية والبلازما في منطقة الإرقاء ، يتم تكوين الثرومبين ، والذي لا يعزز فقط تراكم الصفائح الدموية ، ولكن في نفس الوقت هو محفز لتخثر الدم ، ويشكل الفيبرين الناتج خثرة ، تصبح كثيفة وغير منفذة إلى البلازما والمصل ، يحدث تراجعها.
إلى حد كبير ، أصبحت آلية تراكم الصفائح الدموية واضحة بعد اكتشاف البروستاجلاندين في الصفائح الدموية وجدار الأوعية الدموية. تعمل عوامل التجميع المختلفة على تنشيط فسفوليباز A1 ، الذي يتسبب في انقسام حمض الأراكيدونيك ، وهو مادة تجميع قوية ، من الفوسفوليبيدات. تحت تأثير إنزيم البروستاجلاندين ، تتشكل أكاسيد داخلية دورية من البروستاجلاندين ، والتي تحفز تقلص الألياف في الصفائح الدموية ولها تأثير تراكمي قوي. تحت تأثير إنزيم الثرموبوكسان ، يتم تصنيع الثرموبوكسان A1 في الصفائح الدموية. هذا الأخير يعزز نقل Ca 2+ في الصفائح الدموية ، مما يؤدي إلى تكوين ADP ، محفز التجميع الداخلي الرئيسي. يتم تنظيم مستوى cAMP ، الناقل البيولوجي الشامل ، بواسطة adenylate cyclase ، والذي يحفز تفاعل ATP-cAMP.
تحدث عملية مماثلة في البطانة الوعائية - تحت تأثير البروستاجلاندين synthetase ، تتشكل البروستاجلاندين endoperoxides من حمض الأراكيدونيك. علاوة على ذلك ، تحت تأثير إنزيم البروستاسكلين ، يتم تكوين البروستاسكلين (البروستاغلاندين L) ، والذي له تأثير قوي في تفكيك التجمعات وينشط إنزيم الأدينيلات.
وهكذا ، فإن ما يسمى ب. ثرموبوكسان - توازن البروستاسكلين - أحد المنظمين الرئيسيين لحالة نغمة جدار الأوعية الدموية وتجمع الصفائح الدموية.
رابط التجلط من الارقاء
تشارك المركبات الموجودة في البلازما (مواد التخثر) في عملية تخثر الدم. هذه عملية إنزيمية معقدة متعددة المراحل ، ويمكن تقسيمها إلى 3 مراحل.
- المرحلة الأولى - مجموعة من التفاعلات التي تؤدي إلى تكوين مركب البروثرومبين النشط أو البروثرومبيناز. يشتمل المركب على العامل X ، وعامل الصفائح الدموية الثالث (الفوسفوليبيد) ، والعامل الخامس وأيونات الكالسيوم 2+. هذه هي أصعب وأطول مرحلة.
- المرحلة الثانية - تحت تأثير البروثرومبيناز ، ينتقل البروثرومبين إلى الثرومبين.
- المرحلة الثالثة - تحت تأثير الثرومبين ، يمر الفيبرينوجين إلى الفبرين.
تتمثل اللحظة الأساسية في تكوين البروثرومبيناز في تنشيط العامل X لتخثر الدم ، والذي يمكن تنفيذه بواسطة آليتين رئيسيتين لتحريك عملية التخثر - الخارجية والداخلية.
بواسطة آلية خارجية ، يتم تحفيز التخثر عن طريق دخول الثرومبوبلازمين النسيجي (III أو مركب phospholipid-apoprotein III) إلى البلازما. يتم تحديد هذه الآلية عن طريق اختبار زمن البروثرومبين (PT).
باستخدام آلية داخلية ، يتم إجراء التخثر دون مشاركة الثرومبوبلاستين في الأنسجة. العامل المسبب في مسار التخثر هذا هو تنشيط العامل X. يمكن أن يحدث تنشيط العامل X بسبب ملامسة الكولاجين في حالة تلف جدار الأوعية الدموية أو بشكل إنزيمي تحت تأثير الكاليكرين أو البلازمين أو البروتياز الأخرى.
في كل من المسارات الخارجية والداخلية للتخثر ، يتم التفاعل وتفعيل العوامل على أغشية الفسفوليبيد ، حيث يتم إصلاح عوامل تخثر البروتين بمساعدة أيونات الكالسيوم.
تسميات عوامل تخثر البلازما:
- أنا - الفبرينوجين
- الثاني - البروثرومبين
- الثالث - ثرومبوبلاستين الأنسجة ؛
- رابعا - الكالسيوم
- V - عامل التسريع ؛
- منشط العامل الخامس ؛
- السابع - البروكونفيرتين.
- الثامن - الجلوبيولين المضاد للهيموفيليك أ ؛
- التاسع - العامل المضاد للحيوية B (عامل الكريسماس) ؛
- X - البروثرومبيناز.
- الحادي عشر - سلائف الثرومبوبلاستين البلازمية ؛
- الثاني عشر - عامل هاجمان ؛
- الثالث عشر - الفبريناز.
لا يتم عزل الآليات الخارجية والداخلية لتفعيل نظام تخثر الدم عن بعضها البعض. إن إدراج "الجسور" بينهما بمثابة علامة تشخيصية في التعرف على التنشيط داخل الأوعية الدموية لنظام التخثر. عند تحليل نتائج اختبارات التخثر الأساسية ، يجب مراعاة ما يلي:
- من بين عوامل تجلط الدم في البلازما ، يدخل العامل السابع فقط في الآلية الخارجية للتخثر ، ومع نقصه ، يطول زمن البروثرومبين فقط.
- العوامل XII و IX و XI و VIII و Prekallikrein تشارك فقط في آلية التنشيط الداخلية ، وبالتالي ، عندما تكون ناقصة ، يتم اضطراب APTT واختبار التخثر التلقائي ، بينما يظل زمن البروثرومبين طبيعيًا.
- مع وجود نقص في العوامل X ، V ، II ، I ، حيث يتم إغلاق آليتي التخثر ، يتم الكشف عن علم الأمراض في جميع الاختبارات المذكورة أعلاه.
بالإضافة إلى الآليات الخارجية والداخلية لتخثر الدم في الجسم ، هناك مسارات تنشيط احتياطي إضافية يتم تنشيطها عند الطلب. أهم مسار هو البلاعم - آلية أحادية الخلية للتخثر الدموي. عندما يتم تنشيطها عن طريق السموم الداخلية أو غيرها من المستضدات المعدية ، تبدأ هذه الخلايا في إفراز المزيد من الثرومبوبلاستين في الأنسجة.
مثبطات التخثر الذاتية
مضادات التخثر الفسيولوجية ضرورية للحفاظ على الدم في حالة سائلة وللحد من عملية تجلط الدم. من المعروف الآن أن مضادات التخثر الطبيعية تمثل مجموعة كبيرة من المركبات التي تعمل في مراحل مختلفة من عملية الإرقاء. علاوة على ذلك ، فإن العديد من مضادات التخثر تؤثر في وقت واحد على تكوين الفيبرين ، وتوليد نظام كاليكرين-كينين ، والنظام التكميلي.
تنقسم مضادات التخثر الطبيعية إلى أولية ، موجودة باستمرار في البلازما وخلايا الدم وتعمل بغض النظر عن تكوين أو انحلال الجلطة الدموية ، والثانوية ، والتي تحدث أثناء تخثر الدم وانحلال الفيبرين ، بسبب عمل التحلل البروتيني للإنزيم على الركيزة. يتم حساب ما يصل إلى 75٪ من إمكانات مضادات التخثر الطبيعية بواسطة مضاد الثرومبين III (AT III). Antithrombin III قادر على منع البروثرومبيناز عن طريق الآليات الخارجية والداخلية ، نظرًا لكونه مثبطًا للعوامل XII a و XIa و IX a و VIII a و kallikrein و A III يربط البلازمين. تم تعزيز نشاط مضاد الثرومبين الثالث بأكثر من 100 مرة في تكوين مجمعات الهيبارين. الهيبارين ، خارج ارتباطه بمضاد الثرومبين III ، ليس له تأثير مضاد للتخثر. مع انخفاض مستوى مضاد الثرومبين الثالث ، تحدث حالة شديدة من التهاب الوريد الخثاري ، والتي تتميز بتجلط الدم المتكرر ، والانسداد الرئوي ، والنوبات القلبية. مع انخفاض في مضاد الثرومبين III إلى أقل من 30 ٪ ، يموت المرضى من الجلطات الدموية ، وليس للهيبارين تأثير مضاد للتخثر على دمائهم. يشكل نقص مضاد الثرومبين III مقاومة الهيبارين.
تشمل مضادات التخثر الطبيعية البروتين C ، والبروتين S ، و alpha2-macroglobulin.
البروتين C هو مادة طليعية يتم تنشيطها بواسطة الثرومبين والعامل Xa. يحدث التنشيط بالاشتراك مع الفوسفوليبيد والكالسيوم. يتم تعزيز العملية تحت تأثير الثرومبومودولين والبروتين S ، مما يضعف قدرة الثرومبين على تنشيط العاملين الثامن والخامس. مع نقص البروتين C ، هناك ميل للتخثر ، والذي لوحظ في DIC الحاد ، متلازمة الضائقة التنفسية ، إلخ.
في عملية تخثر الدم وانحلال الفيبرين ، تتشكل مضادات التخثر الطبيعية الثانوية نتيجة لمزيد من التحلل الأنزيمي لعوامل التخثر.
مضادات التخثر المرضية غائبة في الدم في ظل الظروف العادية ، ولكنها تظهر مع اضطرابات مناعية مختلفة ، وتشمل هذه الأجسام المضادة لعوامل تخثر الدم ، وغالبًا ما تحدث للعوامل الثامن والخامس (غالبًا ما تحدث بعد الولادة وعمليات نقل الدم الضخمة والمركبات المناعية - مضاد الذئبة للتخثر ومضاد الثرومبين الخامس).
نظام الفبرين
يتكون نظام تحلل الفبرين من البلازمينوجين ومنشطاته ومثبطاته.
منشطات البلازمينوجين هي مجموعة من العوامل التي تحول البلازمينوجين إلى بلازمين. وتشمل هذه المواد مثل urokinase والإنزيمات البكتيرية. يتم حظر البلازمين النشط بسرعة بواسطة مضادات البلازمين ويتم التخلص منه من مجرى الدم. يتم تنشيط انحلال الفبرين ، وكذلك تنشيط تخثر الدم ، على طول المسارين الخارجي والداخلي.
يرجع المسار الداخلي لتنشيط انحلال الفبرين إلى نفس عوامل تجلط الدم ، أي العوامل XIIa أو XIII مع kallikrein و kininogen. يتم تنفيذ مسار التنشيط الخارجي بسبب المنشطات من نوع الأنسجة التي يتم تصنيعها في البطانة. تم العثور على المنشطات من نوع الأنسجة في العديد من الأنسجة وسوائل الجسم وخلايا الدم. يتم تثبيط انحلال الفبرين عن طريق مضادات البلازمين alpha2-globulin و alpha2-macroglobulin و antitrypsin وما إلى ذلك. يتم تكييف نظام البلازمين مع تحلل الفيبرين في الجلطات (الجلطات) ومجمعات الفيبرين أحادية الذوبان (SFMK). وفقط مع التنشيط المفرط يحدث تحلل الفبرين والفيبرينوجين والبروتينات الأخرى. يسبب البلازمين النشط انقسامًا متسلسلًا للفيبرينوجين / الفيبرين مع تكوين نواتج التحلل (PDF) ، والتي يشير وجودها إلى تنشيط انحلال الفبرين.
كقاعدة عامة ، في معظم الحالات السريرية ، يكون تنشيط انحلال الفبرين ثانويًا ويرتبط بتخثر الدم داخل الأوعية الدموية.
في عملية التخثر وانحلال الفبرين ، تظهر مضادات التخثر الطبيعية والطبيعية - PDP وعوامل تخثر الدم الأخرى - نشطة بيولوجيًا ، والتي تعمل كمضادات للتجلط ومضادات التخثر.
حاليًا ، تتميز المضاعفات المناعية الخثارية وعيوب الإرقاء الوراثية.
نظام الإرقاء أثناء الحمل
وجهة النظر السائدة هي أنه في جسد المرأة الحامل ، شروط معينةلتطوير متلازمة التخثر داخل الأوعية الدموية المنتشرة. يتم التعبير عن هذا في زيادة إمكانات التخثر الكلية (النشاط الكلي لعوامل التخثر) ، وزيادة في النشاط الوظيفي للصفائح الدموية مع انخفاض طفيف في عددها ، وانخفاض نشاط تحلل الفبرين مع زيادة في PDP ، وانخفاض في نشاط مضاد الثرومبين III مع انخفاض طفيف في محتواه. هذه الميزات ذات طبيعة تعويضية تكيفية وهي ضرورية للتكوين الطبيعي للمركب الجنيني وللحد من فقدان الدم أثناء الولادة. في تنشيط نظام الإرقاء ، تلعب التغييرات في ديناميكا الدم العامة في جسم المرأة الحامل دورًا مهمًا. من أجل الأداء الطبيعي لجهاز المشيمة الجنيني في ظل ظروف ارتفاع احتمالية تخثر الدم ، تدخل آليات التكيف التعويضي: زيادة في عدد الزغابات الطرفية ذات العيار الصغير مع تضخم وترتيب طرفي للشعيرات الدموية ، وانخفاض في سمك حاجز المشيمة مع ترقق المخلوط ، وتشكيل الأغشية المخلوية ، العقيدات المخلوية.
ترتبط ميزات عمل نظام الإرقاء ببعض التغييرات في نظام الشرايين الحلزونية للرحم. هذا هو غزو خلايا الأرومة الغاذية في جدار الشرايين الحلزونية ، واستبدال الغشاء المرن الداخلي والوسائط الداخلية بطبقة سميكة من الفيبرين ، وانتهاك سلامة البطانة والتعرض للبنى تحت البطانية الكولاجينية. في هذه العملية ، من المهم أيضًا نشر المساحة الفاصلة مع ميزاتها المورفولوجية والديناميكية الدموية.
يتم تحديد ميزات نظام الإرقاء أثناء الحمل الفسيولوجي من خلال تكوين الدورة الدموية الرحمية.
يظل مستوى الصفائح الدموية في الحمل غير المصحوب بمضاعفات دون تغيير تقريبًا ، على الرغم من وجود دراسات لوحظ فيها انخفاض في مستوى الصفائح الدموية. مع انخفاض مستويات الصفائح الدموية عن 150.000 / مل ، يلزم إجراء دراسات لتحديد أسباب قلة الصفيحات.
أثناء الحمل ، لوحظ زيادة في إمكانية التخثر ، حيث يستعد الجسم ، كما كان ، لاحتمال حدوث نزيف أثناء الولادة. لوحظت زيادة في جميع عوامل التخثر باستثناء العامل الحادي عشر والثالث عشر.
تبدأ الزيادة في مستوى الفيبرينوجين من الشهر الثالث من الحمل ، وعلى الرغم من زيادة حجم البلازما المنتشرة ، فإن مستوى الفيبرينوجين في نهاية الحمل يزيد مرتين على الأقل مقارنة بالحالة غير الحوامل.
يزيد نشاط العامل الثامن (عامل فون ويلبراند) أيضًا ليس فقط في النساء الأصحاء ، ولكن أيضًا في مرضى الهيموفيليا والمرضى المصابين بمرض فون ويلبراند. يجب أن يؤخذ في الاعتبار أنه مع وجود درجة خفيفة ومتوسطة من هذا المرض ، يمكن أن يكون مستوى هذا العامل طبيعيًا تقريبًا. على عكس الزيادة العامة في عوامل التخثر ، لوحظ انخفاض طفيف في العامل الحادي عشر في نهاية الحمل وانخفاض ملحوظ في العامل الثالث عشر (عامل استقرار الفيبرين) أثناء الحمل. الدور الفسيولوجيهذه التغييرات ليست واضحة بعد.
تزداد أيضًا إمكانية تخثر الدم بسبب انخفاض مستوى مضاد الثرومبين III ، ويزداد البروتين C بشكل رئيسي في فترة ما بعد الولادة ، وينخفض البروتين S أثناء الحمل وينخفض بشكل ملحوظ بعد الولادة.
أثناء الحمل ، لوحظ انخفاض في انحلال الفبرين في نهاية الحمل وأثناء الولادة. في فترة ما بعد الولادة المبكرة ، يعود نشاط انحلال الفبرين إلى طبيعته. هناك بيانات متضاربة في الأدبيات بشأن وجود PDP في مجرى الدم. وفقًا لنتائج الدراسة ، كانت هناك زيادة طفيفة في PDF في الأشهر الأخيرة من الحمل. وفقًا للدراسات ، في الحمل غير المعقد ، لا يتم اكتشاف زيادة في محتوى منتجات التحلل حتى بداية الولادة. وفقًا لـ J. Rand et al. (1991) ، يرتفع مستوى بعض شظايا منتجات تحلل الفيبرين من 16 أسبوعًا من الحمل ويصل إلى هضبة في 36-40 أسبوعًا. ومع ذلك ، فإن الزيادة الكبيرة في PDP أثناء الحمل هي على الأرجح انعكاس لعملية تحلل الفبرين بسبب تنشيط التخثر داخل الأوعية الدموية.
تغييرات في نظام الإرقاء عند النساء الحوامل المصابات بمتلازمة أضداد الفوسفوليبيد
تختلف مؤشرات نظام الإرقاء عند النساء الحوامل المصابات بمتلازمة أضداد الشحوم الفوسفورية بشكل كبير عن تلك الموجودة في النساء ذوات الدورة الفسيولوجية للحمل. منذ بداية الحمل في معظم المرضى ، لوحظت تغييرات في ارتباط الصفائح الدموية بالإرقاء. يكون تراكم الصفائح الدموية أثناء تحفيز ADP أعلى بنسبة 55-33٪ منه خلال الدورة الفسيولوجية للحمل. يستمر الاتجاه نحو زيادة التجميع على خلفية العلاج المضاد للصفيحات.
يكون تراكم الصفائح الدموية تحت تأثير الكولاجين 1.8 مرة أعلى منه في الدورة الفسيولوجية للحمل. يزيد تراكم الصفائح الدموية تحت تأثير الأدرينالين بنسبة 39٪ عن المجموعة الضابطة. إذا لم يكن من الممكن تقليل هذه المؤشرات تحت تأثير العلاج المستمر ، فإن فرط نشاط الصفائح الدموية المستمر هو الأساس لزيادة جرعة العوامل المضادة للصفيحات أو وصف عوامل إضافية مضادة للصفيحات. مؤشرات الريستومايسين - يظل التجميع في المتوسط في الأشهر الثلاثة الأولى ضمن النطاق الطبيعي. أظهرت الدراسات أنه منذ بداية الحمل في المرضى الذين يعانون من APS ، هناك تفاعل متزايد للصفائح الدموية لتأثيرات المحاثات البيولوجية ، والتي تم تحديدها بشكل أساسي في اختبارات النشاط الوظيفي للصفائح الدموية ، مثل التجميع تحت تأثير ADP 1x10 3 M و 1x10 5 م ، حمض الأراكيدونيك.
عند تقييم الخصائص النوعية حسب أنواع أنماط التجميع ، لم تظهر ملاحظة واحدة التفصيل (التجميع القابل للانعكاس) تحت تأثير المحفزات الضعيفة لـ ADP 1 x 10 7 M. ويتضح هذا من خلال التغيير في ملف تعريف المنحنيات نحو ما يسمى بأنماط التجميع المفرطة الوظيفية "غير النمطية".
تم أيضًا تغيير مؤشرات ارتباط البلازما للإرقاء في الأشهر الثلاثة الأولى من الحمل مقارنةً بالتحكم: لوحظ تسارع كبير في AVR ، وتم تقصير المؤشر r + k على مخطط التخثر الدموي ، وهو مؤشر الخصائص الهيكلية للفيبرين الجلطة - كان ITP أعلى بكثير.
وهكذا ، في النساء الحوامل المصابات بـ APS بالفعل في الأشهر الثلاثة الأولى من الحمل ، لوحظ فرط تخثر معتدل في رابط الإرقاء بالبلازما ، والذي يتطور قبل فرط التخثر المرتبط بتكيف الإرقاء أثناء الحمل الفسيولوجي. هذه التغييرات ، التي تحدد فرط نشاط الإرقاء بشكل عام في الأشهر الثلاثة الأولى من الحمل ، لا تعتبر تنشيطًا مرضيًا للتخثر داخل الأوعية الدموية ، وذلك بسبب نادرًا جدًا في عمر الحمل هذا ، لاحظنا ظهور علامات DIC - منتجات تحلل الفيبرين والفيبرينوجين (FDP). لم يتجاوز محتوى PDF في الأشهر الثلاثة الأولى 2 × 10 جم / لتر. كان هذا هو السبب في اعتبار فرط نشاط مكونات الصفائح الدموية والبلازما للإرقاء كفرط تخثر لا يتوافق مع عمر الحمل وخلفية تطور مدينة دبي للإنترنت.
في الثلث الثاني من الحمل ، على الرغم من العلاج ، لوحظت تغييرات في مستوى البلازما للإرقاء. وجد أن APTT هو 10٪ و AVR 5٪ أقصر من الحمل العادي. تشير هذه البيانات إلى زيادة فرط التخثر. لوحظ نفس الاتجاه على مخطط الخثرات المرنة: مؤشرات التخثر الكرونومترية r + k ، ومعلمات Ma وقيم ITP أعلى مما كانت عليه في الحمل الطبيعي.
في رابط الصفائح الدموية للإرقاء ، هناك زيادة ذات دلالة إحصائية في التجميع وزيادة في أنواع المنحنيات ذات الوظائف المفرطة عند التعرض للمنبهات الضعيفة ، مما يشير إلى استمرار فرط نشاط الصفائح الدموية لدى النساء الحوامل المصابات بـ APS ، المقاومة للعلاج.
في الثلث الثالث من الحمل ، لوحظ نفس الاتجاه نحو زيادة ظاهرة فرط التخثر ، على الرغم من العلاج المستمر. مؤشرات تركيز الفيبرينوجين ، AVR و APTT ، تشير إلى تطور فرط تخثر الدم. على الرغم من التحكم الأكبر في مخططات الإرقاء ، فإن التدابير العلاجية تمكنت من الحفاظ على فرط التخثر ضمن حدود قريبة من المعلمات الفسيولوجية.
بالنظر إلى أن المثبطات الطبيعية الرئيسية لتخثر الدم يتم تصنيعها بواسطة جدار الأوعية الدموية ، بما في ذلك أوعية المشيمة ، فمن الأهمية بمكان تقييم النشاط الكلي لمثبط منشط البلازمينوجين (PAI) مع تقدم الحمل لدى النساء المصابات بمتلازمة أضداد الفوسفوليبيد . أظهر تحديد محتوى PAI ، الذي تم إجراؤه في ديناميات الحمل ، أنه في النساء الحوامل المصابات بمتلازمة أضداد الشحوم الفوسفورية لا توجد زيادة في عمل الحجب لـ PAI 1 و PAI 2 في المشيمة.
كانت الزيادة القصوى في مثبط منشط البلازمينوجين في بعض الحالات 9.2-9.7 وحدة / مل (عادة ، هذا الرقم هو 0.3-3.5 وحدة / مل) على خلفية نشاط ومحتوى عاليين من البلازمينوجين ، الركيزة الأساسية للفيبرين (112) -115٪ و 15.3-16.3 جم / لتر بمعدل 75-150٪ و 8 جم / لتر على التوالي). لوحظت العلامات المبكرة للنشاط المرضي لنظام الإرقاء (تجلط الدم) في الأشهر الثلاثة الأولى من حيث مستوى معقد مضاد الثرومبين الثالث غير النشط (TAT) فقط في الملاحظات الفردية ، مما يؤكد التوليد الفعلي داخل الأوعية الدموية للنشاط المحفز للتخثر.
أتاحت الدراسات التي أجريت على مكونات آليات مضادات التخثر لنظام الإرقاء تحديد تباين كبير في محتوى البروتين C (PrC) ؛ في معظم الحالات ، لا يعتمد الانخفاض في مستواه على مدة الحمل. لم يتجاوز الحد الأقصى لنشاط PrS 97٪ ، وفي معظم الحالات كان 53-78٪ (القاعدة 70-140٪).
أظهر تحليل فردي لمحتوى مثبط منشط البلازمينوجين في الثلث الثاني من الحمل زيادة حادة في مثبط منشط البلازمينوجين إلى 75 وحدة / مل فقط في حالة واحدة ، بينما كان هناك مزيج من زيادة في مثبط منشط البلازمينوجين مع علم أمراض واضح لـ AT III ، نشاط 45.5٪ ، تركيز 0.423 جم / لتر. في جميع الملاحظات الأخرى ، تراوح محتوى مثبط منشط البلازمينوجين من 0.6-12.7 وحدة / مل ، بمتوسط 4.7 ± 0.08 وحدة / مل. علاوة على ذلك ، في الثلث الثالث من الحمل ، ظل محتوى مثبط منشط البلازمينوجين منخفضًا أيضًا ، وتراوحت التقلبات من 0.8 إلى 10.7 وحدة / مل ، في المتوسط 3.2 ± 0.04 وحدة / مل ، فقط في ملاحظة واحدة - 16.6 وحدة / مل. مل. بالنظر إلى أن الزيادة الحادة في محتوى مثبط منشط البلازمينوجين تساهم عادةً في انخفاض نشاط تحلل الفبرين والتخثر الموضعي (بسبب قمع انحلال الفبرين الإصلاحي) ، يمكن اعتبار الحقائق التي لاحظناها على أنها عدم وجود تفاعل بطاني عند الحوامل النساء المصابات بـ APS ، تهدف إلى تخليق المكون البطاني لـ PAI 1 ، المركب بواسطة جدران البطانة الوعائية ، والأهم من ذلك ، غياب نظام المكون المشيمي لـ PAI 2 ، الذي تنتجه أوعية المشيمة. قد يكون التفسير المحتمل للعوامل التي نلاحظها هو خلل في الخلايا البطانية ، وقبل كل شيء ، الأوعية المشيمة عند النساء الحوامل المصابات بمتلازمة أضداد الفوسفوليبيد ، ربما بسبب تثبيت معقدات الأجسام المضادة للمستضد على البطانة.
يُلفت الانتباه إلى انخفاض كبير في نشاط PrS في الثلث الثاني من الحمل ، والذي يقل بنسبة 29٪ عن المجموعة الضابطة.
أظهر تقييم نظام تحلل الفبرين النتائج التالية: كان نشاط البلازمينوجين في معظم الحالات مرتفعًا في الثلث الأول من الحمل ، 102 ± 6.4٪ والتركيز 15.7 ± 0.0 Eg / لتر. في الثلث الثاني من الحمل ، تعرض نشاط البلازمينوجين لتقلبات أكبر من 112 إلى 277٪ وتركيز من 11.7 جم / لتر إلى 25.3 جم / لتر ، بمتوسط 136.8 + 11.2٪ تركيز 14.5 + 0.11 جم / لتر. في الثلث الثالث من الحمل ، بقيت ظروف مماثلة: تراوح نشاط البلازمينوجين من 104 إلى 234٪ (طبيعي 126.8 ± 9.9٪) تركيز من 10.8 إلى 16.3 جم / لتر ، بمتوسط 14.5 ± 0.11 جم / لتر. وبالتالي ، فإن احتمال انحلال الفبرين عند النساء الحوامل المصابات بمتلازمة أضداد الشحوم الفوسفورية مرتفع جدًا.
في المقابل ، كان محتوى المثبط الرئيسي لتحلل الفيبرين ألفا 2-ماكروغلوبولين (alpha 2Mg) مرتفعًا جدًا في الأشهر الثلاثة الأولى من الحمل ، وتراوح من 3.2 إلى 6.2 جم / لتر (عادة 2.4 جم / لتر) ، بمتوسط 3.36 ± 0.08 جم / لتر ؛ في الثلث الثاني من الحمل ، على التوالي ، من 2.9 إلى 6.2 جم / لتر ، بمتوسط 3.82 ± 0.14 جم / لتر.
تم الحصول على بيانات مماثلة فيما يتعلق بمحتوى alpha1-antitrypsin (alfa-AT) ، والتي تراوحت في جميع مراحل الحمل من 2.0 إلى 7.9 جم / لتر. نظرًا لأن CL-Mg و a1-AT مثبطات عازلة للتأثير المتأخر وغير المباشر ، فقد تجلى تأثيرهما على تنشيط نظام تحليل الفبرين ، حتى في ظل ظروف المحتوى العالي من البلازمينوجين ، من خلال انخفاض إمكانات تحلل الفبرين عند النساء الحوامل المصابات بمتلازمة أضداد الفسفوليبيد. ، على غرار ذلك في المسار الفسيولوجي للحمل.
تؤكد السمات المدرجة لنظام الإرقاء على الأهمية الكبرى لدراسات التحكم في الإرقاء أثناء الحمل لتحسين العلاج المضاد للتخثر والوقاية من المضاعفات علاجي المنشأ.
أظهرت دراسة نظام الإرقاء قبل الولادة أن القدرة على الإرقاء تظل سليمة ، وعلى الرغم من العلاج المضاد للصفيحات ، هناك ميل إلى فرط وظيفة الصفائح الدموية.
بالنظر إلى أن المرضى الذين يعانون من متلازمة أضداد الفوسفوليبيد يتلقون عوامل مضادة للتخثر أثناء الحمل ، وبعد الولادة هناك خطر كبير من حدوث مضاعفات الانصمام الخثاري الكامنة في المرضى الذين يعانون من متلازمة أضداد الفوسفوليبيد ، فمن المهم للغاية دراسة الإرقاء في فترة ما بعد الولادة.
يمكن أن يؤدي التقليل من مخططات الإرقاء ، والتوقف عن العلاج فور الولادة إلى تطور سريع لفرط التخثر ومضاعفات الانصمام الخثاري. أظهرت الدراسات أنه بعد الولادة ، تظل احتمالية تجلط الدم مرتفعة ، حتى في تلك الملاحظات التي تلقى فيها المرضى علاج الهيبارين. يجب إجراء دراسات على نظام الإرقاء في اليوم الأول والثالث والخامس بعد الولادة. لوحظ وجود فرط تخثر معتدل في 49٪ من النفاس ، وفي 51٪ من النفاس لوحظ تنشيط نظام الإرقاء - زيادة في فرط التخثر وظهور PDF.
العيوب الخلقية في الارقاء
في الوقت الحالي ، يتم إيلاء الكثير من الاهتمام للأشكال المحددة وراثيًا من أهبة التخثر ، والتي ، مثل متلازمة الفوسفوليبيد ، مصحوبة بمضاعفات الانصمام الخثاري أثناء الحمل وتؤدي إلى فقدان الحمل في أي مرحلة. الأسباب الرئيسية لالتهاب الوريد الخثاري الوراثي: نقص مضاد الثرومبين ، البروتين C و S ، العامل المساعد الهيبارين H ، نقص العامل الثاني عشر ، ديسيفبرينوجين الدم ، نقص فيبرينوجين الدم ، نقص منشط البلازمينوجين النسيجي ، طفرة ليدن في جين عامل التخثر V.
بالإضافة إلى هذه الاضطرابات ، في السنوات الأخيرة ، تمت الإشارة إلى فرط الهوموسستئين في الدم على أنه حالات التهاب الوريد الخثاري الوراثي - وهي حالة يكون فيها ، بسبب خلل وراثي في إنزيم ميثيلين إيتراهيدروفولات ريدوكتاز ، هناك خطر الإصابة بتجلط الدم الوريدي والشرياني ، وبالتالي مع هذا ، فقد الحمل ممكن التنمية في وقت مبكرتسمم الحمل. وتجدر الإشارة إلى أنه في واحدة من أحدث المنشورات لوحظ أن فرط الهوموسستئين في الدم تم اكتشافه في 11٪ من سكان أوروبا. على عكس العيوب الوراثية الأخرى للإرقاء ، لوحظ حدوث خسائر مبكرة للحمل في هذه الحالة المرضية بالفعل في الأشهر الثلاثة الأولى من الحمل. مع فرط الهوموسيستين في الدم ، فإن الوقاية الفعالة للغاية من تجلط الدم هي استخدام حمض الفوليك.
عند تحديد النساء الحوامل المصابات بتجلط الدم الوراثي ، من الضروري إجراء تقييم دقيق للغاية لبيانات التاريخ العائلي. إذا كان لدى أحد الأقارب تاريخ من مضاعفات الانسداد التجلطي في سن مبكرة ، أثناء الحمل ، عند استخدام العلاج الهرموني ، بما في ذلك موانع الحمل الفموية ، فمن الضروري فحص عيوب الإرقاء الوراثية ، حيث يكون خطر حدوث مضاعفات الانصمام الخثاري مرتفعًا للغاية.
يعمل مضاد الثرومبين على تثبيط نشاط الثرومبين والعوامل IXa و Xa و XIa و HPA. يعتبر نقص ألفا 1-مضاد الثرومبين شديد التجلط ويمثل ما يصل إلى 50٪ من تجلط الدم أثناء الحمل. نظرًا لعدم تجانس الاضطرابات ، يختلف معدل حدوث هذا الخلل من 1: 600 إلى 1: 5000.
يعمل البروتين C على تثبيط عوامل Va و VIIIa. يعمل البروتين S كعامل مساعد للبروتين C ، مما يعزز عمله. يحدث نقص البروتين C و S بتردد 1: 500. لا يتغير البروتين C عمليًا أثناء الحمل ، وينخفض البروتين S في النصف الثاني من الحمل ويعود إلى طبيعته بعد الولادة بفترة وجيزة. لذلك ، إذا تم تحديد البروتين S أثناء الحمل ، فيمكن الحصول على نتائج إيجابية خاطئة.
في السنوات الأخيرة ، كان هناك العديد من المنشورات حول أهبة التخثر بسبب طفرة في جين العامل الخامس ، وهذا ما يسمى بطفرة ليدن. نتيجة لهذه الطفرة ، لا يؤثر البروتين C على العامل الخامس ، مما يؤدي إلى التهاب الوريد. تم العثور على هذا المرض في 9 ٪ من سكان أوروبا. يجب تأكيد هذه الطفرة عن طريق اختبار الحمض النووي للعامل الخامس لايدن. يختلف تواتر حدوث طفرة ليدن اختلافًا كبيرًا. لذلك ، وفقًا للباحثين السويديين ، تراوحت نسبة حدوث عيب الإرقاء هذا بين النساء الحوامل المصابات بتجلط الدم من 46 إلى 60٪ ، بينما في إنجلترا - 14٪ فقط وفي اسكتلندا - 8٪.
اضطرابات الإرقاء
مجموعة من العوامل والآليات التي تضمن الحالة المثلى لتجميع الحالة التجميعية للدم.
لتقييم نظام تجلط الدم ، يتم إجراء الاختبارات:
الوقت ومدة النزيف. يتم غمس ثقب إصبع وقطرة بارزة في قطعة من الورق. المعيار هو 45-180 ثانية.
وقت تخثر الدم حسب لي وايت. خذ أنبوب اختبار ورجه حتى تظهر خيوط الفبرين. المعيار هو 6-9 دقائق.
استجابة لتلف الأوعية الدموية ، يحدث تشنج في جدار الأوعية الدموية. تندفع الصفائح الدموية إلى الوعاء التالف ، وتلتصق بجدار الأوعية الدموية (الالتصاق). يلتصقون ببعضهم البعض ويشكلون خثرة الصفائح الدموية. هذه الآليات هي ارقاء الأوعية الدموية والصفائح الدموية.
مرحلة تخثر الدم.
ارقاء التخثر. يمكن تفعيله بطريقتين:
الآلية داخلية ، يتم تنشيطها بواسطة الكولاجين أو البروتياز أو الأدرينالين ، هذه العوامل تؤدي إلى حقيقة أن عامل XII Hageman يتحول إلى بروتين نشط ، عند التنشيط (تسقط مجموعة الأحماض الأمينية وهي الشكل النشط) XIIa XI IX VIII - بالضرورة بمشاركة أيونات Ca تكوين البروثرومبيناز النشط (ثرومبوبلاستين).
الآلية خارجية - تلف الأنسجة. يعزز الثرومبوبلاستين النسيجي (III) انتقال العامل السابع إلى الشكل النشط والنتيجة هي تكوين البروثرومبيناز النشط.
في المرحلة الأولى من تخثر الدم ، هناك 7 ، 8 ، 9 عوامل تجلط الدم.
جلطة دموية أو خثرة.
ينتقل البروثرومبيناز النشط (الثرومبوكيناز) إلى الثرومبين. لها مرحلتان فرعيتان:
تشكيل جرعة أنزيمية من الثرومبين.
تحت تأثير جرعة الاشتعال من الثرومبين ، ينتقل البروكونفيرتين (السابع) إلى المحول (السابع أ). يعيد برنامج Convertin عملية الطي إلى المرحلة الأولى
Proaccelerin (V) يتحول إلى عقار (Va) - يسرع تخثر الدم.
تشكيل الجرعة الناتجة من الثرومبين. البروثرومبين ، برواتشيليرين ، بروكونفيرتين العمل.
يعمل الثرومبين على الفبرين لتكوين الفيبرينوجين. البلمرة والتثبيت. الفيبرينوجين - الفبرينومونومر الفبرين - بوليمرات الفبرين.
المرحلة - انحلال الفبرين.
XII XIIa plasminogen - plasmin (العامل الرئيسي لنظام fibrinolytic) يتم تدمير الفيبرين لمنتجات تحلل الفبرين (تنشط منتجات fibrinolysis المرحلة الأولى من التخثر).
نظام الارقاء.
أهبة النزفية.
وهي مقسمة حسب الضرر الذي يلحق بمكون الإرقاء:
اعتلال الأوعية الدموية:
وراثي:
توسع الشعريات أو مرض راندو أوسلر - موروث بطريقة جسمية سائدة ، أي خلل في بنية جدار الأوعية الدموية ، يصبح أرق وتشكل ectases تشبه الكيس. التوطين: الشفتين ، الجزء العلوي من الجسم ، الوجه ، فروة الرأس ، على الغشاء المخاطي ، في التجاويف. هذه الجدران الضعيفة مصابة بشكل جيد. يصاب المريض بفقر الدم الناجم عن نقص الحديد المزمن نتيجة فقدان الدم المزمن.
تم شراؤها:
نقص فيتامين C (الاسقربوط) ، PP - ضروري لبلمرة جدران الأوعية الدموية - يصاب المريض بالنبرات والتهاب الأوعية الدموية. على مناطق متناظرة من الجلد.
التهاب الأوعية الدموية النزفي (مرض شونلاين - هينوك):
اختبارات لمقاومة جدار الأوعية الدموية: Konchalovsky (يتم ضخ الضغط إلى قيمة معينة في الكفة ، ثم يتم حساب عدد النمشات) ، عاصبة (بعد تطبيق الكفة عند قياس ضغط الدم ، انظر إلى الجلد - سيكون هناك يكون نزيفًا) ، قرصة (قرصة الجلد).
اعتلال الصفيحات:
قلة الصفيحات:
مرض ويرلهوف (فرفرية نقص الصفيحات) موروث بطريقة وراثية سائدة. يتجلى في شكل كدمات ، ويزهر - جلد النمر.
يتم توريث قدرة الطحال على إنتاج مثبط لتكوين الخثرات (عامل الطحال). يمنع هذا العامل انفصال الصفائح الدموية عن الخلايا العملاقة في نخاع العظم ، ويزداد عدد خلايا النواء ، ولا معنى لها.
العلاج: استئصال الطحال.
تم شراؤها: على صورة الهاتف!
التأثير السمي للنخاع:
عوامل خارجية: فيزيائية (إشعاع مؤين) ، كيميائية (تثبيط الخلايا ، مضادات حيوية ، منتجات بترولية) ، بيولوجية (فيروسات ، سموم الكائنات الدقيقة).
ذاتية النمو:
تثبيط البراعم الطبيعية المكونة للدم.
قلة الصفيحات الذاتية.
النتيجة - نزيف الأنف واللثة والرحم والكدمات.
للتمايز ، هناك اختبار حيوي ، يتم حقن مصل المريض في الحيوان. عامل الطحال ليس خاصًا بالأنواع ، لذا فهو يسبب أيضًا قلة الصفيحات في الحيوان.
قلة الصفيحات - انتهاك للخصائص الوظيفية للصفائح الدموية:
وراثي: مرض جلانزمان ، مرض فون ويلبراند (أهبة نزفية معقدة ، لأن البطانة تنتج عادة عامل فون ويلبراند ، وهو جزء لا يتجزأ من العامل 8. والتركيب المنحرف لهذا العامل موروث. عامل ويلبراند هو عامل تخثر).
تم شراؤها:
نقل جرعات كبيرة من الدم والبلازما ومركزات التجلط.
المايلوما المتعددة ، مرض والدنستروم (زيادة مستويات البروتينات الطبيعية وغير الطبيعية).
DVSS (زيادة PDF - منتجات تحلل الفبرين)
الأدوية - مضادات الالتهاب غير الستيروئيدية
نقص فيتامين ج ، ب 12.
آلية وهن الصفيحات:
انتهاك تخليق وتراكم المواد النشطة بيولوجيًا في الخلايا الحبيبية للصفائح الدموية ،
انتهاك التحلل وإطلاق عوامل الصفائح الدموية في بلازما الدم.
تشخيص نقص الصفيحات والوهن:
عدد الصفائح الدموية: 180-400 * 10 9 / لتر.
وقت تجميع الصفائح الدموية: 14-18 ثانية
النسبة المئوية للخلايا التي تم إدخالها في التجميع أكثر من 90.
إطالة الوقت وانخفاض الخلايا التي دخلت - وهن الصفيحات.
اختبار Konchalovsky الإيجابي - تحدد الصفائح الدموية غذاء البطانة الوعائية ، وتفرز عوامل النمو اللازمة للخلايا البطانية. إذا كان هناك عدد قليل من الصفائح الدموية - عيوب ، تزداد هشاشة الأوعية الدموية.
تجلط الدم - انتهاك إرقاء التخثر:
وراثي. مراحل التخثر:
انتهاك المرحلة الأولى من التخثر:
الهيموفيليا A (80٪ من المصابين بالهيموفيليا) - نقص العامل الثامن.
الهيموفيليا B (10٪) - نقص العامل التاسع.
الهيموفيليا C (5٪) - نقص العامل الحادي عشر.
آلية وراثة الهيموفيليا: الهيموفيليا A هو عيب في الكروموسوم X. أب سليم ، أم حاملة: ابن سليم ، ابنة سليمة ، ابنة حاملة ، ابن مصاب بالهيموفيليا. يتجلى المرض مباشرة بعد الولادة ، وقد يعاني المولود من نزيف مختلف (ورم رأسي). أي إصابة تؤدي إلى تكوين ورم دموي (نوع من النزيف). ربما تشكيل تدمي المفصل.
يمكن أن تحدث الهيموفيليا B و C في كل من الرجال والنساء.
تشخيص انتهاكات المرحلة الأولى من التخثر:
وقت إعادة حساب البلازما المنشط (AVR) 40-60 ثانية.
يتم تنشيطه جزئيًا زمن الثرومبوبلاستين (APTT) 33-45 ثانية.
انتهاك المرحلة الثانية:
وراثي (بارايموفيليا): نقص بروثرومبين الدم ، نقص بروتينات الدم ، نقص بروتوكسيليرين الدم.
مكتسبة: فشل الكبد ، أكوليا ، نقص فيتامين ك.
لتقييم حالة المرحلة الثانية ، نقدر مؤشر البروثرومبين (PTI) بنسبة 85-110 ٪.
اضطراب المرحلة الثالثة:
وراثي: نقص فيبرينوجين الدم ، أفبرينوجين الدم ، ديسيفبرينوجين الدم.
يتم الحصول عليها نتيجة إما انخفاض في التوليف ، أو زيادة الاستهلاك (خاصة مع DIC): نقص فيبرينوجين الدم ، أفبرينوجين الدم.
المفاهيم الأساسية لاضطرابات الارقاء:
1. اضطرابات الإرقاء ، تجلط الدم(تجلط الدم ، تجلط الدم- + فطريات يونانية - معاناة ، مرض) - انتهاك لوظيفة تخثر الدم وأنظمة منع تخثر الدم.
2. حالة فرط التخثر - الجلطة- حالة مصحوبة بعملية مرضية لزيادة تخثر الدم بسبب زيادة تراكم الصفائح الدموية ، وتفعيل عوامل تخثر البلازما والأنسجة مع تكوين جلطات الصفائح الدموية والفيبرين.
3. حالة نقص تخثر الدم - النزفية- حالة مصحوبة بعملية مرضية لتقليل تخثر الدم نتيجة انخفاض تراكم الصفائح الدموية ، وتعطيل عوامل تجلط الدم بالبلازما والأنسجة مع حدوث نزيف ونزيف.
4. DIC (حالة التخثر النزفية)- متلازمة التخثر المنتشر داخل الأوعية - عملية مرضية نموذجية لاضطرابات الإرقاء نتيجة تفاعلات تجلط الدم المتتالية: فرط التخثر (تكوين جلطات منتشرة في شبكة الأوعية الدموية الدقيقة) ونقص التخثر (استنفاد عوامل التخثر وزيادة انحلال الفيبرين) ، مصحوبًا بنزيف حاد ، صدمة تخثر الدم الحادة وتنكس حاد في الأعضاء الداخلية.
في أي أمراض يوجد انتهاك للإرقاء:
الإرقاء هو عملية معقدة تمنع أو توقف تدفق الدم من تجويف الوعاء ، وتضمن تكوين تخثر الفيبرين الضروري لاستعادة سلامة الأنسجة ، وأخيراً يزيل الفيبرين عندما لا تكون هناك حاجة إليه. هناك أربع آليات فسيولوجية رئيسية تشارك في هذه العملية.
بمساعدة نظام الإرقاء ، يؤدي الدم وظيفته الأكثر أهمية - الحفاظ على الحالة السائلة لتدفق الدم في الأوعية الدموية ، وتجلط الدم في حالة انتهاك سلامة جدار الأوعية الدموية ، وبالتالي وقف النزيف و الحفاظ على حجم الدم وتكوينه. نظام الإرقاء متعدد المكونات. وهو يشمل الصفائح الدموية وخلايا الدم الأخرى ، وجدار الأوعية الدموية ، والأنسجة خارج الأوعية الدموية ، والمواد النشطة بيولوجيًا (إرقاء الصفائح الدموية الوعائية) ، والبلازما ، وعوامل تخثر الأنسجة (إرقاء التخثر) ، والتي تتفاعل بشكل وثيق مع أنظمة مضادات التخثر ، ومحللات الفبرين وكاليكرين-كينين . يؤدي انتهاك أي من هذه المكونات إلى أمراض الإرقاء.
تصنيف انتهاكات الارقاء. يُصنف علم أمراض الإرقاء وفقًا للآفة السائدة لمكوناته المختلفة إلى اضطرابات إرقاء الصفائح الدموية والأوعية الدموية وإرقاء التخثر. وفقًا للمسببات ، يمكن اكتساب هذه الاضطرابات وراثية ، ووفقًا لاتجاه التغييرات ، يمكن تقسيمها إلى انخفاض في تخثر الدم (hypocoagulation) وزيادة في تخثر الدم (فرط تخثر الدم) ، والتي يمكن أن تكون موضعية ( تجلط الدم) والمعمم (مدينة دبي للإنترنت).
انخفاض تخثر الدم
يتجلى انخفاض تخثر الدم من خلال زيادة النزيف (متلازمة النزف) - النزيف المتكرر والنزيف الذي يحدث بشكل عفوي مع إصابات طفيفة.
يتم إعاقة إرقاء الصفائح الدموية الوعائية مع التغيرات الكمية والنوعية في الصفائح الدموية (قلة الصفيحات الدموية واعتلال الصفيحات) ، وكذلك آفات جدار الأوعية الدموية.
قلة الصفيحات هي انخفاض في محتوى الصفائح الدموية في الدم دون المستوى الطبيعي (180-320 جم / لتر أو 180-320 × 109 / لتر). ومع ذلك ، يحدث النزف التلقائي فقط عندما يكون عددها أقل من 30 جم / لتر. يُفهم اعتلال الصفيحات على أنه نقص نوعي واختلال وظيفي في الصفائح الدموية بمحتواها الطبيعي أو المنخفض.
أسباب انخفاض تخثر الدم. غالبًا ما يكون سبب قلة الصفيحات هو التفاعلات المناعية عندما يتغير التركيب المستضدي للصفائح الدموية تحت تأثير الفيروسات والأدوية وإنتاج الأجسام المضادة الذاتية المضادة للصفيحات (مع سرطان الدم الليمفاوي المزمن ونقص الصفيحات مجهول السبب) وعدم توافق مستضدات الأم والجنين. بالإضافة إلى ذلك ، يتطور قلة الصفيحات نتيجة لتلف جرثومة الخلايا العملاقة في نخاع العظم عن طريق الإشعاع المؤين ، مواد كيميائيةأو إزاحته عن طريق النقائل الورمية ، يتسلل اللوكيميا. قد يكون الانخفاض في عدد الصفائح الدموية بسبب نقص السيانوكوبالامين وحمض الفوليك ، وهو عيب وراثي في تكوين الصفائح الدموية (بما في ذلك نقص الصفيحات). يحدث قلة الصفيحات نتيجة التلف الميكانيكي للصفائح الدموية في تضخم الطحال ، وصمامات القلب الاصطناعية ، وكذلك زيادة استهلاك الصفائح الدموية في التخثر الموضعي والمعمم داخل الأوعية.
تشمل العوامل المسببة للاعتلال الخثاري تأثير المواد والعقاقير السامة (الكحول ، حمض أسيتيل الساليسيليك) ، الإشعاع المؤين ، المستقلبات الذاتية (مع البولينا ، تليف الكبد) ؛ نقص السيانوكوبالامين ، الاضطرابات الهرمونية (قصور الغدة الدرقية). هناك أيضًا عيوب وراثية في بنية الغشاء والتركيب الكيميائي الحيوي للصفائح الدموية (نقص الثرومبوستينين ، العامل 3 ، ATP ، ADP ، G-6-PD ، مستقبلات الغشاء للعوامل الخامس ، الثامن ، الحادي عشر ، إلخ).
في اعتلالات الأوعية الدموية النزفية ، يحدث تلف في جدار الأوعية الدموية ، مما يؤدي إلى انتهاك إرقاء الصفائح الدموية الوعائية والنزيف ، بسبب زيادة نفاذية جدار الأوعية الدموية وتدميرها في انتهاك لتخليق الكولاجين (مع نقص غذائي لحمض الأسكوربيك ، عيوب وراثية في تخليق الكولاجين) ، تحت تأثير المواد النشطة بيولوجيا (الحساسية) ، السموم المشعة (مرض الإشعاع) ، التهاب الأوعية الدموية النزفية المناعية ، انخفاض وظيفة التغذية الوعائية للصفائح الدموية في قلة الصفيحات الدموية واعتلال الصفيحات ، تدمير جدار الأوعية الدموية عن طريق ارتشاح اللوكيميا. أحد أسباب النزيف هو انخفاض إنتاج عامل فون ويلبراند بواسطة بطانة جدار الأوعية الدموية ، وهو مكون جزيئي كبير من عامل تخثر الدم الثامن (مرض فون ويلبراند الوراثي). يتراكم هذا العامل في الصفائح الدموية ويتم إطلاقه أثناء تحللها.
إنه ضروري للالتصاق الطبيعي للصفائح الدموية بجدار الكولاجين ، وبدونها لا تتشكل جلطة الصفائح الدموية. لوحظ أيضًا متلازمة النزف مع زيادة بيروكسيد الفسفوليبيدات الغشائية ، ونتيجة لذلك يتم تصنيع وإفراز كمية زائدة من مثبطات قوية لتراكم الصفائح الدموية ، البروستاسيلينات ، في البطانة. بالإضافة إلى ذلك ، يؤدي انتهاك التنظيم العصبي والخلطي للنغمة الوعائية إلى انخفاض في إرقاء الصفائح الدموية في الأوعية الدموية ، مما يؤدي إلى استحالة انسداد الأوعية الصغيرة بواسطة خثرة الصفائح الدموية.
التسبب في انخفاض تخثر الدم. هناك أربع آليات رئيسية لحدوث قلة الصفيحات: انخفاض الإنتاج ، وزيادة التدمير ، وزيادة الاستهلاك (تجلط الدم) ، وإعادة توزيع الصفائح الدموية.
يرجع انتهاك الإرقاء وتطور النزيف في قلة الصفيحات إلى الآليات التالية:
- زيادة نفاذية الأوعية الدقيقة لخلايا الدم الحمراء وغيرها الأجزاء المكونةالدم (نزيف السكري) وهشاشة الأوعية الدموية بسبب ضمور الجدار عند إيقاف وظيفة التغذية الوعائية للصفائح الدموية ؛
- انخفاض في الوظيفة التراكمية اللاصقة للصفائح الدموية ؛
- انتهاك تفاعل إطلاق عوامل تخثر الصفائح الدموية ، ADP ، السيروتونين ، الأدرينالين ، عامل مضاد الهيبارين ، مما يؤدي إلى عدم كفاية تكوين خثرة الصفائح الدموية ، وغياب التشنج الوعائي وإبطاء التخثر ؛
- انخفاض في انكماش الجلطة نتيجة انخفاض نشاط البروتين الانقباضي للصفائح الدموية - الثرومبوستينين (عامل الصفائح الدموية 8).
في التسبب في اعتلال الصفيحات ، يمكن التمييز بين آليتين رئيسيتين لحدوثهما - إنتاج الصفائح الدموية المرضية في نخاع العظام وتدمير الصفائح الدموية في جميع أجزاء نظام الدم. إن التسبب في إرقاء الصفائح الدموية الوعائية الضعيفة في اعتلال قلة الصفيحات هو نفسه كما هو الحال في قلة الصفيحات ، حيث يرتبط بإغلاق وظائف الصفائح الدموية.
يمكن أن يحدث انتهاك إرقاء التخثر ، مما يؤدي إلى تطور النزيف ، بسبب العوامل التالية:
- النقص أو الانحراف المكتسب والوراثي في تخليق عوامل تخثر البلازما والصفائح الدموية ومكونات نظام كاليكرين-كينين ؛
- تثبيط أو زيادة استهلاك هذه العوامل ؛
- زيادة مضادات التخثر الذاتية.
- تفعيل نظام الفبرين ؛
- جرعة زائدة من مضادات التخثر وأدوية الفيبرين ومزيل الرجفان. كل هذا يكمن وراء انتهاك إحدى المراحل الثلاث لتخثر الدم وانكماش الجلطة ، أو تغيراتها مجتمعة.
أسباب انتهاك المرحلة الأولى من تخثر الدم - تكوين الثرومبوبلاستين - هي انخفاض في إنتاج العوامل (IX ، X) في أمراض الكبد ، وتشكيل الأجسام المضادة لبعض العوامل (VIII ، IX) في الأمراض في التسبب في وجود أحد مكونات المناعة الذاتية (اللوكيميا ، الكولاجين) ، أو جرعة زائدة من مضادات التخثر العالمية مثل الهيبارين. العيوب الجينية في تركيب العوامل الثامن والتاسع والحادي عشر معروفة ، ونقصها يكمن وراء تطور الهيموفيليا (على التوالي ، تسلسل هذه العوامل هو الهيموفيليا A و B و C).
يحدث انتهاك المرحلة الثانية من تخثر الدم - تكوين الثرومبين - ليس فقط في أمراض الكبد ، ولكن أيضًا في نقص فيتامين K ، عندما ينخفض أيضًا تخليق العوامل II ، V ، VII المشاركة في هذه المرحلة في الكبد ( مع اليرقان الانسدادي ، التهاب الأمعاء ، استئصال واسع للأمعاء الدقيقة ، دسباقتريوز المخدرات). ربما ظهور مثبطات المناعة من العوامل V ، VII (على سبيل المثال ، في علاج كبريتات الستربتومايسين) ، زيادة إفرازها عن طريق الكلى ، نقص وراثي (العامل الخامس في بارهيموفيليا) ، أو تثبيط مكونات النظام المضاد للتخثر - مضادات الثرومبين ، الهيبارين (مع صدمة الحساسية ، جرعة زائدة من الهيبارين).
أهبة النزفية المرتبطة بانتهاك المرحلة الثالثة من التخثر - مرحلة تكوين الفيبرين ، يحدث مع انخفاض في تخليق الفيبرين في الكبد ، والرئتين المتأثرة بالعملية المرضية ، أو نتيجة نقص وراثي ، وتكوين الفيبرينوجين الدم ونقص في عامل استقرار الفبرين (العامل الثالث عشر). ومع ذلك ، غالبًا ما يكون انتهاك المرحلة الثالثة ناتجًا عن زيادة انحلال الفبرين في الصدمة (العملية) في الرئتين والرحم والبنكرياس ؛ حرق ، صدمة. ويرجع ذلك إلى زيادة تناول منشطات البروفرينوليسين (البلازمينوجين) في الدم - الأنسجة ، والفيبرينوكينازات الميكروبية ، ومنشطات كريات الدم البيضاء وكريات الدم الحمراء ، ومكونات نظام كاليكرين-كينين والنظام التكميلي لمجمعات الهيبارين مع الفيبرينوجين ، والبروفرينولين والأدرينالين (هذه المركبات توفير انحلال الفبرين غير الأنزيمي ، وفقًا لـ B. A. Kudryashov).
طريقة تطور المرض. الروابط الرئيسية في التسبب في أهبة النزف ، والتي نشأت في انتهاك لأي مرحلة من مراحل تخثر الدم ، هي فقدان الدم المزمن وعواقبه ، وكذلك التغيرات الهيكلية والوظيفية في موقع النزيف (في المفاصل والأعضاء الداخلية والجلد والأنسجة الأخرى).
زيادة تخثر الدم
تتجلى زيادة تخثر الدم من خلال التخثر الموضعي (تجلط الدم) أو التخثر داخل الأوعية المعمم ، والذي يعتمد على انتهاك الصفائح الدموية الوعائية وإرقاء التخثر.
قد يكون سبب فرط التخثر:
- زيادة في النشاط الوظيفي لنظام تخثر الدم بسبب زيادة - - تناول محفزات التخثر ومنشطات تخثر الدم في الدم ؛
- زيادة في محتوى الصفائح الدموية في الدم.
- انخفاض في الخصائص المضادة للتخثر لجدار الأوعية الدموية ؛
- انخفاض في نشاط نظام الدم المضاد للتخثر.
- إضعاف انحلال الفبرين.
التخثر المعمم (المنتشر) داخل الأوعية (DIC) هو اضطراب حاد في الإرقاء يحدث عند الإفراط في تناول المواد المسببة للتخثر ومنشطات التخثر في الدم ، مما يؤدي إلى تكوين خثرات متعددة في الأوعية الدموية الدقيقة ، ثم تطور نقص التخثر. ، قلة الصفيحات والنزيف نتيجة "استهلاك" عوامل نظام التخثر وزيادة في النشاط الوظيفي لنظام منع تخثر الدم وانحلال الفيبرين في الدم ، متبوعًا باستنفاد جميع الأنظمة الثلاثة.
المسببات. ترجع عالمية مدينة دبي للإنترنت وعدم خصوصيتها إلى تنوع العوامل المسببة لحدوثها. وتشمل هذه ، أولاً وقبل كل شيء ، العدوى العامة وحالات الإنتان ، وجميع أنواع الصدمات ، والعمليات الجراحية المؤلمة ، وأمراض التوليد (الانفصال المبكر ، والفصل اليدوي للمشيمة) ، وانحلال الدم الحاد داخل الأوعية ، وبولي الدم في الفشل الكلوي ، وجميع الحالات النهائية.
طريقة تطور المرض. الرابط الرئيسي في التسبب في فرط تخثر الدم المعمم هو عدم التوازن بين كاليكريين-كينين ، التخثر ، منع تخثر الدم وانحلال الفبرين عندما يدخل عدد كبير من منشطات التخثر إلى قاع الأوعية الدموية. يؤدي هذا إلى تعطيل وظيفة مهمة للدم مثل الحفاظ على حالته الطبيعية للتجمع ، ونتيجة لذلك ، خلال مرحلة فرط التخثر ، يتخثر الدم في الأوعية ويتوقف دورانها مع تطور ضمور شديد. واضطرابات وظيفية في الأعضاء والأنسجة ، وغالبًا ما تتعارض مع الحياة. في المرحلة اللاحقة من نقص التخثر ، يؤدي ترقق الدم وفقدان القدرة على التجلط وتجمع الصفائح الدموية إلى حدوث نزيف يصعب علاجه علاجيًا. بنتيجة إيجابية ، تبدأ المرحلة الثالثة - مرحلة التعافي ، حيث يتم تطبيع الإرقاء.

الفسيولوجيا المرضية في نظام الإرقاء
أهمية نظام الارقاء
1. الحفاظ على الدم في حالة سائلة (نسبة كافية من نشاط نظامي التخثر ومنع تخثر الدم)
2. الوقاية من النزيف والسيطرة عليه (الحفاظ على حجم ثابت من الدورة الدموية)

أنواع الإرقاء
VASCULAR-THROMBOCYTE
(أساسي)
- توقف عن النزيف في المايكروفسيلز
تجلط الدم
(ثانوي)
تشكيل الجلطات الليفية

مكونات نظام الإرقاء
* جدار الأوعية الدموية
* الصفائح(حيدات ، كرات الدم الحمراء)
* أنظمة البلازما:
- بروجولانتس
- مضادات التخثر
- حال الفبرين
- كاليكرين-كينين

تصنيف اضطرابات الإرقاء
للمسببات
- تراثي
- مشتريات
وراء آلية التنمية
- اضطرابات الصفيحة الوعائية
التخثر
- اضطرابات تخثر الدم
لاتجاه التغييرات
- تخثر الدم
- فرط التخثر

تخثر الدم
انخفاض قدرة الدم على التجلط مع الميل إلى إعادة النزف والنزيف (تلقائيًا أو بعد صدمة طفيفة)

المسببات
1. ثرومبوسيتوبينيا
2. العلاج بالآفة
3. الأوعية الدموية
4. تجلط الدم

قلة الصفيحات
حالة مرضية تتميز بانخفاض عدد الصفائح الدموية في الدم (أقل من 150 - 109 / لتر)

تجلط الدم الوراثي
كقاعدة عامة ، يصاحبها في نفس الوقت عيوب خلقية في الصفائح الدموية

اكتساب ثرومبوسيتوبينيا (التصنيف حسب آلية التنمية)
تلف الصفائح
- المجمعات المناعية
- صدمة ميكانيكية (تضخم الطحال ، ورم وعائي)
منع تشكيل الصفائح
(فقر الدم اللاتنسجي ، الضرر الكيميائي والإشعاعي لنخاع العظام الأحمر ، استبدال الأنسجة المكونة للدم بورم)
زيادة استخدام الصفائح
(تجلط الدم ، مدينة دبي للإنترنت)

جهاز المناعة
HETEROIMMUNE
* يحدث في كثير من الأحيان في أطفال
** سبب- تغيير في التركيب المستضدي للصفائح الدموية (عند الحصبة الألمانية والجدري والفيروسات الغدية ؛ هابتينز من أصل دوائي - كينيدين ، سلفوناميدات ، ريفامبيسين ؛ لقاحات)
***التيار موات(عندما يتم القضاء على السبب ، يحدث الشفاء التام)

جهاز المناعة
AUTOIMMUNE
يحدث بشكل متكرر في الكبار
سبب- نقص التحمل المناعي لمستضدات الصفائح الدموية
العوامل المؤثرة:الأدوية والفيروسات والبكتيريا

قلة الصفيحات الذاتية
مرض ويرلهوف
(فرفرية نقص الصفيحات المزمن المناعي الذاتي)
* على سطح الصفائح الدموية العدد مفتشيزيد 10 مرات
* الموقع الرئيسي لتوليف Ig G هو طحال
* مبدأ العلاج:
- استئصال الطحال
- الستيرويدات القشرية
- مثبطات المناعة
* لا يوجد علاج كامل


ثرومبووسيتوبث
ضعف الارقاء بسبب الدونية النوعية أو الخلل الوظيفي للصفائح الدموية ، والتي تتميز بانتهاك ارقاء الأوعية الدموية والصفائح الدموية ، وظهور نزيف في الأنسجة والأعضاء

بدون إزعاج من الحبيبات أطلقوا رد الفعل
الوهن الخثاري جلانزمان
* الوراثة - صفة جسدية متنحية
*سبب- عدم وجود البروتينات السكرية 2 ب و 3 أ في غشاء الصفائح الدموية
*طريقة تطور المرض- لا تتفاعل الصفائح الدموية مع الفيبرينوجين ولا تتجمع
*علامات:نمشات ، نزيف في الأنف ، نزيف الرحم ( يمكن أن تكون قاتلة !!)

اعتلال الصفيحات الوراثي
مع الحبيبات المعطلة أطلق سراح التفاعل
ميراث- صفة متنحية
سبب- انتهاك نشاط انزيمات الأكسدة الحلقية ، وانخفاض نشاط البروتينات المقلصة
طريقة تطور المرض- لا تتراكم عند التفاعل مع الكولاجين ، لا تطلق الحبيبات
علامات:

اعتلال الصفيحات الوراثي
مع انتهاك الحبيبات وإفراز محتوى الحبيبات
مرض Herdzhmansky-Pudlak (AR)
* سبب- انتهاك تراكم الحبيبات الكثيفة (ADP ، الأدرينالين ، السيروتونين ، Ca2 +)
* طريقة تطور المرض- لا يوجد تراكم عند التفاعل مع الكولاجين ، ولا يتم تحرير محتويات الحبيبات
* علامات:نمشات ، نزيف في الأنف ، نزيف رحمي

اعتلال الصفيحات الوراثي
مع انتهاك الالتصاق وتجميع الصفائح
متلازمة فون ويلبراند يورجنز (AR)
سبب - نقص عامل فون ويلبراند
طريقة تطور المرض - ضعف التصاق الصفائح الدموية بسبب نقص العامل 8
مرض برنارد سولييه (AR)
سبب - عدم وجود بروتين سكري 1 على الصفائح الدموية
طريقة تطور المرض - ضعف تفاعل الصفائح الدموية مع عامل فون ويلبراند ، و. 5 ، ص. أحد عشر
علامات - نزيف شعري خطير بشكل خاص أثناء البلوغ أو الولادة)

اعتلال الصفيحات الوراثي
النقص وقلة التوفر و 3
اعتلال الصفيحات باوي و برج الحمل
سبب - نقص الصفائح الدموية f.3
طريقة تطور المرض - لا يوجد تفاعل بين الصفائح الدموية ومضادات التخثر
علامات: نمشات ، نزيف في الأنف ، نزيف رحمي

اعتلال الصفيحات الوراثي
اعتلال الصفيحات بالاشتراك مع تشوهات وراثية أخرى
متلازمة ويسكوت الدريدج
- سبب- يوجد عدد قليل من الحبيبات الكثيفة في الصفائح الدموية (ADP ، السيروتونين ، الأدرينالين ، Ca2 +) ، حبيبات ألفا (بيتا ثرومبوغلوبولين ، الفيبرينوجين ، فيبرونيكتين ، عامل النمو)
- طريقة تطور المرض- انخفاض التصاق وتكدس الصفائح الدموية ، وضعف إطلاق الحبيبات
- علامات:تظهر المتلازمة النزفية في وقت مبكر ، وقد يكون هناك نزيف قاتل

اعتلال الصفيحات المكتسب (المسببات)
1. سرطان الدم- عدد قليل من الحبيبات في الصفائح الدموية بسبب النضج المتسارع ، وانخفاض الالتصاق والتجمع
2. تكتل Ig M - تلف المستقبلات بواسطة المجمعات المناعية ، وانتهاك تفاعل الصفائح الدموية مع مواد التخثر (أمراض المناعة)
3. نقص فيتامين B12 - ضعف إطلاق الحبيبات
4. التأثيرات الطبية

اعتلال الصفيحات الطبية
* و مثبطات تخليق الثرموبوكسان A2
- العقاقير الستيرويدية المضادة للالتهابات
- العقاقير غير الستيرويدية المضادة للالتهابات (الأسبرين يمنع تراكم الصفائح الدموية لمدة 4-6 أيام)
* محفزات تكوين cAMP
-بابافيرين
- يوفيلين
-المنشطة
* مناهضات أيون الكالسيوم
- فيراباميل
- كورينفار

الأوعية الدموية
أهبة نزفية بسبب الدونية الوظيفية والمورفولوجية لجدار الأوعية الدموية
- خلقي
- مكتسب

الأوعية الدموية الخلقية
بول. Rendu-Osler (توسع الشعيرات النزفي)
بول. فابري (ورم وعائي وعائي منتشر في الجذع)
ورم الأوعية الدقيقة الوراثي

الأوعية الدموية الخلقية
سبب - اضطراب وراثي في تطور النسيج الضام ، بما في ذلك. البطانة الوعائية
صفة مميزة
- ترقق الأوعية الدموية البؤري
- توسيع تجويف الاوعيه الدقيقة
- عدد قليل من ألياف الكولاجين في البطانة التحتية
- إصابة السفن بسهولة
- ضعف التصاق وتكدس الصفائح الدموية نتيجة نقص ألياف الكولاجين
**علامات- نزيف في الأنف ، رئوي ، قصبي ، معدي معوي (بعضها مميت)

الحصول على الأوعية الدموية
1. و ديوباتي(ساركوما كابوزي)
- المسببات - غير معروف
2. راكد(التهاب الجلد كلوتز ، التهاب الجلد فافر-راكوشوت)
- المسببات - قصور القلب المزمن ، القصور الوريدي الموضعي
3. ضمور
برفرية الستيرويد - فرط وظيفة الغدد الكظرية ، العلاج بالكورتيكوستيرويدات - تمنع تخليق الكولاجين
Scorbut - نقص فيتامين سي
Bol.Schönlein-Genocha - تلف الأوعية الدموية بواسطة المجمعات المناعية
4. عصبي
العلامات السريرية - أشكال نزيف الجلد


تجلط الدم
أهبة النزفية ، والتي تحدث نتيجة لعلم أمراض نظام تخثر الإرقاء
** وراثي
** مكتسب

التخثر الوراثي
اضطراب محدد وراثيًا في تخثر الدم بسبب نقص أو شذوذ جزيئي للمواد المسؤولة عن إرقاء التخثر

التخثر الوراثي
تصنيف
1. تجلط الدم الناتج عن انتهاك منعزل للآلية الداخلية لتشكيل نشاط البروثرومبيناز (الهيموفيليا A ، B ، C ، مرض فون ويلبراند ، نقص هاجمان)
2. تجلط الدم بسبب انتهاك معزول للآلية الخارجية لتشكيل نشاط البروثرومبيناز (نقص بروتينات الدم - نقص 7 ف.)
3. الانتهاك المشترك للآلية الخارجية والداخلية لتشكيل نشاط البروثرومبيناز (بارهيموفيليا - نقص 5 ف. ، ب. ستيوارت براور - نقص 10 ف.)
4. انتهاك المرحلة النهائية من تخثر الدم (أفبرينوجينيميا)

إحصائيات
من بين جميع أشكال تجلط الدم تعاني:
الهيموفيليا A 68 - 78٪
ب . ويلبراند 9 - 18٪
الهيموفيليا ب 6 - 13٪
الهيموفيليا C ، بارايموفيليا ونقص فرط الدم 1-2٪
أشكال أخرى - علم الحالات السريرية

الهيموفيليا أ
أهبة نزفية بسبب النقص الوراثي للجزء المحفز للتخثر من العامل 8
العامل 8 (بروتين عالي الوزن الجزيئي)
1. منشطات بروتين سكري (VIII: K)
2. بروتين سكري التصاق الصفائح الدموية (VIII: PV)
3. بروتين سكري ينشط التصاق الصفائح الدموية تحت تأثير الريستومايسين (VIII: Rkof)
4. علامة الأنتيجين VIII: K (VIII: K AG)
5. علامة المستضد الثامن: Rkof (VIII: Rkof AG)
نشاط VIII: K و VIII: يتناقص VW مع انخفاض في البنية متعددة الأقطاب و 8 عوامل فقط

الهيموفيليا أ
* هـ علم تيولوجيا- شذوذ في الجين الموجود على الكروموسوم X الذي يتحكم في التركيب الجزء المناهض للتخثر و. 8(الثامن: ك)
** مرضى - رجال (46 ، س ص)
** أنواع
- الهيموفيليا A + (شكل إيجابي للمستضد - غير طبيعي الثامن: ك) يعاني 8-10٪
- الهيموفيليا A- (شكل سلبي للمستضد - غير مركب الثامن: ك) يعاني 90-92٪
**** عيادة:نزيف في المفاصل الكبيرة ، ورم دموي (تحت الجلد ، عضلي) ، نزيف حاد وطويل بعد الصدمة. نزيف محتمل في أعضاء البطن ، نزيف معدي معوي


الهيموفيليا
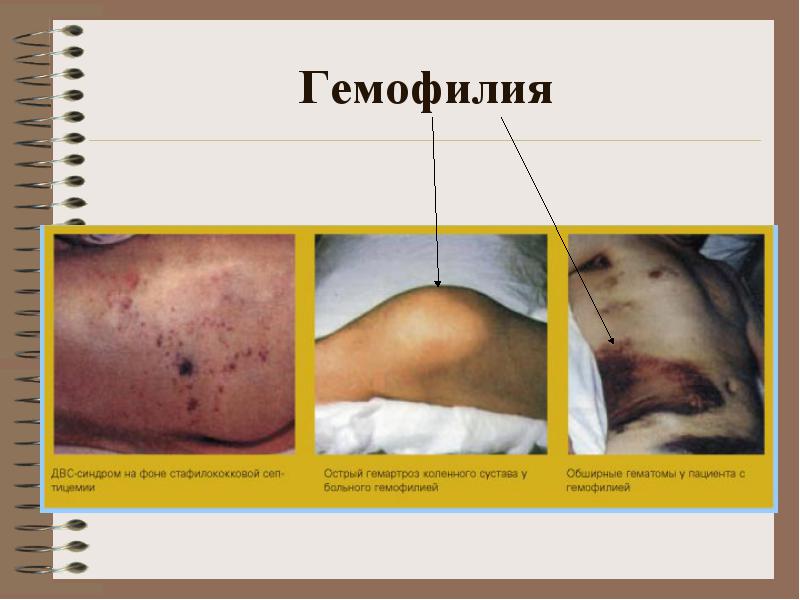
الهيموفيليا

الهيموفيليا ب
المسببات - شذوذ في الجين في الكروموسوم X ، الذي يتحكم في تركيب f. 9
مرضى - رجال (46 ، XY)
- النساء (46 ، XhXh) ، (45 ، Xh O)
*** أنواع
- الهيموفيليا B + (شكل إيجابي للمستضد - غير طبيعي F. 9)
- الهيموفيليا B- (شكل سلبي للمستضد - غير مركب F. 9)
عيادة:نزيف في المفاصل الكبيرة ، ورم دموي (تحت الجلد ، عضلي) ، نزيف حاد وطويل بعد الصدمة. نزيف محتمل في أعضاء البطن ، نزيف معدي معوي

الحصول على التجلط الدموي
خصوصية - عوز
المسببات
1. تثبيط المناعة من محفزات التخثر (صراع الريس)
2. نقص فيتامين عوامل التخثر المعتمدة على K. (7, 10, 9, 2)
أ) انتهاك التوليف في الأمعاء (دسباقتريوز ، إسهال)
ب) سوء امتصاص فيتامين. ك (نقص الصفراء)
ج) تلف الكبد الشديد
3. جرعة زائدة من الهيبارين

فرط التخثر
زيادة قدرة الدم على تكوين جلطات في الأوعية
التخثر
تناذر مدينة دبي للإنترنت

متلازمة DIC (متلازمة تخثر الدم داخل الأوعية الدموية)
تصنيف
* عن طريق الدورة السريرية
1) حاد (الأشكال الآنية تتميز بدورة شديدة)
2) مزمن
* بالانتشار
1) مترجمة
2) معمم

المسببات
الالتهابات وظروف الصرف الصحي
صدمة (مع الإنتان - معدل الوفيات 100٪)
التدخلات الجراحية والحروق
جميع الحالات النهائية ، سكتة قلبية
انحلال الدم الحاد داخل الأوعية
أمراض التوليد (20-25٪)
الأرومة الدموية (مع اللوكيميا - 33-45٪)
العمليات المدمرة في الأعضاء المتني
ردود الفعل التحسسية

مراحل مدينة دبي للإنترنت
1) فرط تخثر الدم (تكوين جلطات متعددة بسبب تنشيط نظام التخثر)
2) استهلاك تجلط الدم (استنفاد نظام التخثر ، والإفراط في استخدام الصفائح الدموية لتشكيل جلطات الدم)
3) نقص التخثر (انخفاض نشاط التخثر ، تنشيط مضادات التخثر ، تنشيط انحلال الفيبرين)
4) إتمام (شفاء ، مضاعفات ، موت)

التسبب في مدينة دبي للإنترنت
1) فرط تجلط الدم(يدخل الثرومبوبلاستين الدم بكميات كبيرة من الأنسجة التالفة ويساهم في تكوين الثرومبين). في حالات العدوى ، تُصنِّع الخلايا الضامة المنشطة أحادية الخلية مواد التخثر الخاصة بها (f.7، f.10، f.9، f.2)

التسبب في مدينة دبي للإنترنت
2) تجمع هائل للصفائح الدموية(يسبب تطور قلة الصفيحات الاستهلاكية ومعقد بسبب النزيف)
3) صدمة وانحلال الدم من كريات الدم الحمراء(هذا يطلق الكثير من ADP ، مما يعزز التصاق الصفائح الدموية وتجميعها)

التسبب في مدينة دبي للإنترنت
4) "انفجار البروتياز الخلطي" (عند تنشيط محفزات التخثر ومضادات التخثر ومزيلات الفبرين وبروتينات نظام كاليكرين كينين والنظام المتمم والعديد من منتجات تكسير البروتين تتراكم في الدم وهي شديدة السمية وتضر بالأوعية الدموية والأنسجة)

التسبب في مدينة دبي للإنترنت
5) استنفاد نظام التحلل الليفي
(يعزز تجلط الدم)
6) نضوب عوامل التخثر
(يسبب تطور النزيف)

عيادة مدينة دبي للإنترنت
1. صدمة التخثر الدموي
سبب
* اضطرابات دوران الأوعية الدقيقة (تسبب تطور نقص الأكسجة في الأنسجة).
* تراكم المواد السامة الناتجة عن تحلل البروتين
المظاهر
* خفض ضغط الدم
* انخفاض الضغط الوريدي المركزي
* النزيف (إثارة صدمة نزفية).

عيادة مدينة دبي للإنترنت
2. اضطرابات الإرقاء
أ) فرط تخثر الدم
المظهر الرئيسي هو تجلط الدم.
تخثر الدم في أنبوب الاختبار
ب) نقص التخثر
العرض الرئيسي هو النزيف.
(في نفس الوقت ينضب نظام انحلال الفبرين)

عيادة مدينة دبي للإنترنت
3. قلة الصفيحات
يحدث بسبب تكوين عدد كبير من الجلطات الدموية في الأوعية (قلة الصفيحات الاستهلاكية)

