Комплекс механизмов, поддерживающий кровь в жидком состоянии, без ее свертывания в просвете сосуда или просачивания через сосудистую стенку, получил название гемостаза. Так как патологические состояния, связанные со свертыванием крови разбираются в следующей лекции, то здесь следует рассмотреть другие изменения, связанные с нарушениями гемостаза.
Кровотечением (геморрагией, от греч. haima - кровь и rhein - течь) называется выход крови за пределы сосудистого русла или сердца в окружающую среду (наружное кровотечение) или в полости тела, просвет полого органа (внутреннее кровотечение). Примерами наружного кровотечения являются метроррагия (маточное), мелена (кишечное), а внутреннего - гемоперикард, гемоторакс, гемоперитонеум и гемартроз (в полость перикарда, плевры, брюшной полости или сустава соответственно).
В зависимости от источника кровотечения делятся на артериальные, венозные, артериально-венозные (смешанные), капиллярные, паренхиматозные (капиллярные из паренхиматозных органов) и сердечные.
Частным видом кровотечения является кровоизлияние, при котором кровь накапливается экстраваскулярно в тканях. Различают четыре его разновидности:
Гематома - кровоизлияние с нарушением целостности тканей и образованием полости;
Геморрагическое пропитывание (инфильтрация) - кровоизлияние с сохранением целости ткани;
Кровоподтек (синяк) - плоскостное кровоизлияние в коже, подкожной клетчатке, слизистых оболочках;
Петехии - точечные кровоизлияния в коже, слизистых и серозных оболочках, внутренних органах.
Множественные петехиальные кровоизлияния, сливающиеся между собой в более крупные по размерам, называют геморрагической пурпурой, а кровоподтек до 2 см диаметром - экхимозом.
К механизмам развития как кровотечений, так и кровоизлияний относят:
Разрыв (haemorragia per rhexin), возникающий вследствие травм неизмененного сосуда или некроза (разрыв сердца при инфаркте миокарда), воспаления (сифилитический мезаортит с разрывом аорты), аневризмы пораженной сосудистой стенки;
Разъедание (haemorragia per diabrosin), или аррозивное кровотечение, развивающееся при разрушении сосудистой стенки воспалением (чаще гнойным), злокачественной опухолью, некрозом (казеозный некроз в кровоточащей туберкулезной каверне), воздействии химических веществ (желудочный сок может вызвать кровотечение из язвы желудка), прорастании ворсинами хориона сосудов маточной трубы при внематочной беременности;
Диапедез (haemorragia per diapedesin, от греч. dia - через, pedao - скачу), отличающийся выходом крови за счет повышения сосудистой проницаемости, как правило, сохранных сосудов микроциркуляторного русла при тяжелой гипоксии, интоксикации, инфекции, различных коагулопатиях, геморрагических диатезах. Сравнительно часто диапедезные кровоизлияния развиваются при гипертоническом кризе, системных васкулитах, лейкозах, гемофилии, уремии.
Склонность к спонтанным кровотечениям или кровоизлияниям в ответ даже на незначительное повреждение получило название геморрагического диатеза. Такое состояние связано с качественными или количественными изменениями тромбоцитов, недостаточностью гемокоагуляции, патологической ломкостью или повышенной проницаемостью сосудистой стенки как наследственными, так и приобретенными.
Основными причинами кровотечений (кровоизлияний) являются:
1. Повышенная ломкость сосудистой стенки отмечается при врожденных ее дефектах, инфекциях и интоксикациях, гипо- и авитаминозах, стероидной терапии;
2. Дефекты тромбоцитов. К ним относятся тромбоцитопении любого генеза, наследственные или приобретенные ослабления адгезии (болезни фон Виллебранда, Бернара-Сулье, наследственный геморрагический диатез и др.), ослабленная агрегация или уменьшение секреции тромбоцитов;
3. Недостаточность факторов коагуляции врожденного (гемофилия А по фактору VIII, гемофилия В по фактору IX, болезнь фон Виллебранда, по другим факторам свертывания крови) или чаще приобретенного происхождения (при заболеваниях печени, дефиците витамина К, некоторых иммунных поражениях);
4. Избыточная внутрисосудистая коагуляция, например, при диссеминированном внутрисосудистом свертывании крови - ДВС-синдроме (см. следующую лекцию).
Исход кровоизлияний может быть благоприятным (рассасывание излившейся крови, организация, инкапсуляция, образование "ржавой" кисты) и неблагоприятным (нагноение при присоединении инфекции).
Значение кровотечения обусловлено его видом, выраженностью и продолжительностью. Так, разрыв сердца при инфаркте миокарда с формированием гемоперикарда быстро приводит к смерти больного, хотя общее количество излившейся крови составляет обычно не более 100-200 г. При артериальном кровотечении может развиться массивная кровопотеря и острое малокровие с летальным исходом. Длительное небольшое кровотечение из хронической язвы желудка или двенадцатиперстной кишки обусловливает хроническую постгеморрагическую анемию. Значение кровоизлияния зависит, прежде всего, от его локализации и лишь затем от его размеров. Даже небольшое кровоизлияние в головной мозг может вызвать поражение жизненно важных центров, отек мозга и смерть больного, тогда как даже массивные неосложненные кровоизлияния в подкожную клетчатку не представляют опасности для жизни.
Плазморрагия - выход из просвета сосуда плазмы крови с пропитыванием окружающих тканей (плазматическое пропитывание) вследствие повышенной сосудистой проницаемости. Плазморрагия происходит трансэндотелиально за счет ультрафильтрации (выход плазмы через поры базальной мембраны эндотелия за счет повышения гидростатического или осмотического давления), диффузии (обусловленной градиентом плазменных компонентов в просвете и вне сосуда), микровезикулярного транспорта (микропиноцитоз или цитопемзис, происходящий вследствие активности ферментативных систем эндотелиоцитов). Возможен и интерэндотелиальный выход плазмы. Таким образом, плазморрагия определяется повреждением сосудистой стенки (прежде всего ее интимы) и изменением констант крови. При морфологическом исследовании стенка сосудов микроциркуляторного русла утолщается, становится гомогенной, а при электронно-микроскопическом исследовании в набухших эндотелиоцитах отмечается большое количество микровезикул, образование фенестр и туннелей, появление межклеточных щелей, разрыхление базальной мембраны интимы. Накопление плазменных компонентов приводит к повреждению клеток и межклеточного вещества как в сосудистой стенке, так и периваскулярных тканях, в исходе которого развивается гиалиноз, а в тяжелых случаях - фибриноидный некроз.
Шок - тяжелое патологическое состояние, характеризующееся циркуляторным коллапсом (острой недостаточностью кровообращения) после сверхсильного воздействия на гемостаз. Различают гиповолемический, кардиальный, септический и сосудистый типы шока.
Гиповолемический шок обусловлен быстрым уменьшением на 20% и более объема циркулирующей крови, что отмечается при острой кровопотере, обезвоживании. Так, потеря жидкости и электролитов возможна при обширных ожогах (вследствие выхода плазмы из поврежденных микроциркуляторных сосудов), при тяжелой рвоте, профузной диарее.
Кардиальный шок развивается в ответ на снижение ударного объема при поражении сердца, наблюдается при инфаркте миокарда, тяжелом миокардите, острой митральной или аортальной недостаточности, тромбозе протезированного клапана, разрыве межжелудочковой перегородки, гемотампонаде сердечной сорочки. Выраженное падение артериального давления приводит к значительному снижению кровенаполнения тканей, аналогичному гипо- волемическим изменениям.
Септический (токсико-инфекционный) шок возникает при наличии инфекции, вызванной грамотрицательной (Е. coli, Proteus, Klebsiella и др.) реже грамположительной (стафило-, стрепто-, пневмококки) микрофлорой. Выделяемые токсины (прежде всего эндотоксины) активируют системы комплемента, коагуляции, фибринолиза, а также тромбоциты и нейтрофилы. В результате стимулируются образование оксида азота (мощного вазодилятатора), фактора некроза опухолей а, интерлейкинов, вызывающих острую недостаточность кровообращения.
Сосудистый (перераспределительный) шок может быть нейрогенным (травматическим, болевым, при повреждении спинного мозга, как осложнение наркоза) или анафилактическим, вызванным генерализованными реакциями гиперчувствительности. Вследствие выраженной вазодилатации, повышения проницаемости капилляров и артериовенозного сброса происходит перераспределение внутрисосудистого объема крови, сопровождающееся значительным снижением общего периферического сосудистого сопротивления.
Шок в своем развитии проходит три стадии:
1. Непрогрессирующая (ранняя) стадия шока характеризуется снижением давления крови и объема сердечного выброса с сохранением относительно нормального кровенаполнения жизненно важных органов. Это происходит за счет компенсаторной вазоконстрикции сосудов, прежде всего кожи и кишечника. При истощении адаптивных механизмов шок переходит в следующую стадию;
2. Прогрессирующая стадия шока отличается выраженной клинической симптоматикой, глубоким коллапсом, обусловленным пониженным кровенаполнением всех органов и тканей (тканевой гипоперфузией из-за увеличивающейся артериальной дилата- ции), развитием метаболических и циркуляторных расстройств. 3. В необратимую стадию шока наблюдается выраженная недостаточность кровообращения на уровне микроциркуляторного русла с нарушением целостности сосудистой стенки, быстро нарастающей полиорганной недостаточностью, заканчивающейся смертью больного.
При морфологическом исследовании отмечаются генерализованные дистрофические и некротические изменения, явления ДВС-синдрома (петехиальные кровоизлияния, стаз, тромбы в микроциркуляторном русле). Помимо этого в связи с особенностями строения и функционирования различных органов в каждом из них возникают своеобразные изменения - шоковые органы. Так, для шоковой почки характерно развитие некротического нефроза (некроза эпителия извитых канальцев). Шоковое легкое проявляется очагами ателектазов, серозно-геморрагического отека, иногда с выпадением нитей фибрина (гиалиновые мембраны). В мозгу возникает ишемическая энцефалопатия, проявляющаяся отеком, точечными кровоизлияниями и очагами некроза. В сердце наблюдают мелкие, преимущественно субэндокардиальные очаги кровоизлияний и некроза миокарда, жировую дистрофию кардиомиоцитов с явлениями их пересокращения. В корковом слое надпочечников происходит уменьшение вплоть до полного исчезновения липидов, использующихся для синтеза стероидных гормонов. В желудочно-кишечном тракте обнаруживают кровоизлияния, эрозии и острые язвы в слизистой оболочке. Шоковая печень отличается жировой дистрофией гепатоцитов, а в отдельных случаях даже их центролобулярным некрозом.
Прогноз шока зависит от его типа, тяжести, стадии, на которой начато лечение, наличия осложнений. В настоящее время при тяжелом кардиогенном или септическом шоке летальность достигает 50% и выше.
Состояние системы гемостаза определяет течение и исход беременности для матери и плода. В последние годы отмечается значительное число публикаций, указывающих на большую роль тромбофилических осложнений в привычном невынашивании, внутриутробной гибели плода, отслойке плаценты, в развитии эклампсии, задержке внутриутробного развития.
Основные механизмы гемостаза
Системой гемостаза или системой регуляции агрегатного состояния крови (PACK) называют биологическую систему, которая обеспечивает регуляцию агрегационного состояния крови и поддержание необходимого для организма гемостатического потенциала. Система PACK мозаична, т.е. гемостатический потенциал в различных участках кровотока неодинаков. Это состояние является нормальным для функциональной системы. В систему регуляции агрегатного состояния крови включаются:
- центральные органы системы - костный мозг, печень, селезенка;
- периферические образования - тучные клетки, эндометрий и другие слои сосудистой стенки, клетки крови;
- местные регуляторные системы - вегетативная нервная система, подкорковые структуры.
Система гемостаза регулируется сложными нейрогуморальными механизмами. Эти механизмы создают условия, при которых начавшийся местно процесс свертывания, необходимый для остановки кровотечения, не переходит при нормальном функционировании системы в процесс общего внутрисосудистого свертывания.
Выделяют четыре основных звена в системе гемостаза:
- Сосудисто-тромбоцитарное звено;
- Прокоагулянты;
- Фибринолитическое звено;
- Звено ингибиторов свертывания крови.
Сосудисто-тромбоцитарное звено
Сосудисто-тромбоцитарное звено системы гемостаза нередко обозначают как первичный гемостаз. Эндотелий кровеносных сосудов играет важную роль в поддержании агрегатного состояния циркулирующей крови. Это связано со следующими его особенностями:
- способностью образовывать и выделять в кровь мощный ингибитор агрегации тромбоцитов - простациклин (метаболит арахидоновой кислоты);
- продукцией тканевого активатора фибринолиза;
- неспособностью к контактной активации системы свертывания крови;
- созданием антикоагулянтного потенциала на границе кровь/ткань путем фиксации на эндотелии комплекса гепарин-антитромбин III;
- способностью удалять из кровотока активированные факторы свертывания.
Участие тромбоцитов в гемостазе определяется их способностью к адгезии у места повреждения эндотелия, процессом их агрегации и образования первичной тромбоцитарной пробки, а также их способностью поддерживать спазм сосудов путем секреции вазоактивных веществ - адреналина, норадреналина, серотонина, АДФ и др., а также образовывать, накапливать и секретировать вещества, стимулирующие адгезию и агрегацию.
Таким образом, многочисленные исследования, позволили сделать вывод, что первичный гемостаз осуществляется в основном тромбоцитами, а не свертыванием крови. Ведущая роль в реализации первичного гемостаза принадлежит адгезивно-агрегационной функции тромбоцитов.
Адгезия - прилипание тромбоцитов к участку повреждения сосудистой стенки, кколлагеновым волокнам сосудистой стенки, к микрофибрину и эластину. Важнейшими плазменными кофакторами этого процесса являются ионы кальция и синтезируемый в эндотелии белок - фактор Виллебранда и гликопротеиды тромбоцитарной мембраны. Физиологическое назначение адгезии - закрыть дефект сосудистой стенки. Одновременно с адгезией протекает агрегация тромбоцитов. При этом тромбоциты не только склеиваются между собой, но и прилипают к адгезированным тромбоцитам, благодаря чему образуется гемостатическая пробка. Из тромбоцитов в процессе адгезии и агрегации активно секректируются гранулы, содержащие вещества, усиливающие процесс агрегации и образующие ее вторую волну. Реакция высвобождения тромбоцитарных факторов - АДФ, адреналина, норадреналина, серотонина, антигепаринового фактора, бета-тромбоглобулина и др. Позднее секретируются гранулы, содержащие лизосомальные ферменты (реакция освобождения II). Выход адреналина, норадреналина и серотонина не только усиливает агрегацию, но и способствует вторичному спазму кровеносных сосудов, что сопровождается надежной фиксацией тромбоцитарной пробки у места повреждения сосуда. В результате взаимодействия тромбоцитарных и плазменных факторов в зоне гемостаза образуется тромбин, который не только усиливает агрегацию тромбоцитов, но одновременно является стимулятором свертывания крови, образующийся при этом фибрин формирует тромб, который становится плотным и непроницаемым для плазмы и сыворотки, происходит его ретракция.
В значительной степени механизм агрегации тромбоцитов стал понятен после открытия простагландинов в тромбоцитах и сосудистой стенке. Различные агрегирующие агенты активируют фосфолипазу А1, которая вызывает отщепление от фосфолипидов арахидоновой кислоты - мощного агрегирующего вещества. Под влиянием простагландинсинтетазы образуются циклические эндоперекиси простагландинов, стимулирующих в тромбоцитах сокращение фибрилл и оказывающих мощное агрегирующее действие. Под влиянием тромбоксансинтетазы в тромбоцитах синтезируется тромбоксан А1. Последний способствует транспорту Са 2+ в тромбоците, что приводит к образованию АДФ - основного эндогенного стимулятора агрегации. Уровень цАМФ-универсального биологического переносчика регулируется аденилатциклазой, катализирующей реакцию АТФ-цАМФ.
Аналогичный процесс происходит в эндотелии сосудов - под влиянием простагландинсинтетазы из арахидоновой кислоты образуются эндоперекиси простагландинов. Далее под влиянием простациклинсинтетазы образуется простациклин (простагландин L), который обладает мощным дезагрегирующим действием и активизирует аденилатциклазу.
Таким образом, формируется т.н. тромбоксан - простациклиновый баланс - один из основных регуляторов состояние тонуса сосудистой стенки и агрегации тромбоцитов.
Прокоагулянтное звено гемостаза
В процессе свертывания крови принимают участие соединения, содержащиеся в плазме (прокоагулянты). Это сложный многоэтапный ферментный процесс, который можно условно разделить на 3 стадии.
- I стадия - комплекс реакций, приводящих к образованию протромбин активного комплекса или протромбиназы. В состав комплекса входят фактор X, третий фактор тромбоцитов (фосфолипид), V фактор и ионы Са 2+ . Это наиболее сложная и длительная фаза.
- II стадия - под влиянием протромбиназы протромбин переходит в тромбин.
- III стадия - под влиянием тромбина фибриноген переходит в фибрин.
Ключевым моментом образования протромбиназы является активация X фактора свертывания крови, что может осуществляться двумя основными механизмами запуска процесса свертывания - внешним и внутренним.
При внешнем механизме свертывание стимулируется поступлением в плазму тканевого тромбоплазмина (III или комплекса фосфолипид-апопротеин III). Этот механизм определяется тестом протромбинового времени (ПВ).
При внутреннем механизме свертывание осуществляется без участия тканевого тромбопластина. Пусковым фактором при этом пути свертывания является активация фактора X. Активация фактора X может происходить за счет контакта с коллагеном при повреждении сосудистой стенки или ферментным путем под влиянием калликреина, плазмина или других протеаз.
Как при внешнем так и при внутреннем пути свертывания взаимодействие и активация факторов осуществляется на фосфолипидных мембранах, на которых с помощью ионов Са фиксируются белковые факторы свертывания.
Номенклатура плазменных факторов свертывания:
- I - фибриноген;
- II - протромбин;
- III - тканевой тромбопластин;
- IV - кальций;
- V - акселерирующий фактор;
- VI - активатор V фактора;
- VII - проконвертин;
- VIII - антигемофильный глобулин А;
- IX - антигемофильный фактор В (фактор Кристмаса);
- X - протромбиназа;
- XI - плазменный предшественник тромбопластина;
- XII - фактор Хагемана;
- XIII - фибриназа.
Внешний и внутренний механизм активации свертывающей системы крови не изолированы друг от друга. Включение «мостов» между ними служит диагностическим признаком при распознавании внутрисосудистой активации системы свертывания. При анализе результатов основных коагуляционных тестов необходимо учитывать следующее:
- Из плазменных факторов свертывания лишь фактор VII участвует во внешнем механизме свертывания, и при его дефиците удлиняется лишь протромбиновое время.
- Факторы XII, IX, XI, VIII и прекалликреин участвует только во внутреннем механизме активации, в связи с чем при их дефиците нарушается АЧТВ и аутокоагуляционный тест, в то время как протромбиновое время остается нормальным.
- При дефиците факторов X, V, II, I на которых замыкаются оба механизма свертывания, патология выявляется во всех перечисленных тестах.
Помимо внешнего и внутреннего механизмов гемокоагуляции в организме имеются дополнительные резервные пути активации, которые включаются по «требованию». Наиболее важным путем является макрофагальный - моноцитарный механизм гемокоагуляции. При активации эндотоксинами или другими инфекционными антигенами эти клетки начинают секретировать большее количество тканевого тромбопластина.
Эндогенные ингибиторы коагуляции
Для поддержания крови в жидком состоянии и для ограничения процесса тромбообразования необходимы физиологические антикоагулянты. В настоящее время известно, что естественные антикоагулянты представляют собой большую группу соединений, действующих на различные фазы процесса гемостаза. Более того многие антикоагулянты одновременно влияют на фибриногенез, генерацию калликреин-кининовой системы, систему комплемента.
Естественные антикоагулянты разделяют на первичные, постоянно присутствующие в плазме и форменных элементах крови и действующие независимо от образования или растворения кровяного сгустка, и вторичные, которые возникают в процессе свертывания крови и фибринолиза, благодаря протеолитическому действию фермента на субстрат. До 75% естественного антикоагулянтного потенциала приходится на долю антитромбина III (AT III). Антитромбин III способен блокировать протромбиназу как по внешнему так и по внутреннему механизму, т.к., являясь ингибитором факторов XII а, ХIа, IX а, VIII а, калликреина, A III связывает плазмин. Активность антитромбина III усиливается более чем в 100 раз при образовании комплексов с гепарином. Гепарин вне связи с антитромбином III не обладает антикоагулянтным действием. При снижении уровня антитромбина III возникает тяжелое тромбофилическое состояние, которое характеризуется рецидивирующими тромбозами, тромбоэмболиями легочной артерии, инфарктами. При снижении антитромбина III ниже 30% больные погибают от тромбоэмболии, причем гепарин не оказывает на их кровь антикоагулянтного действия. Дефицит антитромбина III формирует гепарино-резистентность.
К естественным антикоагулянтам относится протеин С, протеин S, альфа2-макроглобулин.
Протеин С - профермент, активируется тромбином и фактором Ха. Активация идет в комплексе с фосфолипидом и кальцием. Процесс усиливается под влиянием тромбомодулина и протеина S, который ослабляет способность тромбина активировать факторы VIII и V. При дефиците протеина С отмечается склонность к тромбозам, что наблюдается при остром ДВС-синдроме, респираторном дистресс-синдроме и др.
В процессе свертывания крови и фибринолиза образуются вторичные, естественные антикоагулянты в результате дальнейшей ферментативной деградации факторов свертывания.
Патологические антикоагулянты отсутствуют в крови в нормальных условиях, но появляются при различных иммунных нарушениях, к ним относятся антитела к факторам свертывания крови, чаще всего к факторам VIII и V (нередко возникающие после родов и массивных гемотрансфузий и иммунные комплексы - волчаночный антикоагулянт, антитромбин V).
Фибринолитическая система
Фибринолитическая система состоит из плазминогена и его активаторов и ингибиторов.
Плазминоген-активаторы - группа факторов, которые превращают плазминоген в плазмин. К ним относятся такие вещества какурокиназа, бактериальные энзимы. Активный плазмин быстро блокируется антиплазминами и элиминируется из кровотока. Активация фибринолиза, как и активация свертывания крови осуществляется как по внешнему, так и по внутреннему пути.
Внутренний путь активации фибринолиза обусловлен теми же факторами, что и свертывание крови, т.е. факторами ХIIа или XIII с калликреином и кининогеном. Внешний путь активации осуществляется за счет синтезируемых в эндотелии активаторов тканевого типа. Активаторы тканевого типа содержатся во многих тканях и жидких средах организма, клетках крови. Ингибируется фибринолиз антиплазминами альфа2-глобулином, альфа2- макроглобулином, антитрипсином и др. Плазминовая система адаптирована к лизису фибрина в сгустках (тромбах) и растворимых фибрин-мономерных комплексах (РФМК). И только при чрезмерной ее активации возникает лизис фибрина, фибриногена и других белков. Активный плазмин вызывает последовательное расщепление фибриногена/фибрина с образованием продуктов их деградации (ПДФ), наличие которых свидетельствует об активации фибринолиза.
Как правило, в большинстве клинических наблюдений активация фибринолиза вторична и связана с диссеминированным внутрисосудистым свертыванием крови.
В процессе свертывания и фибринолиза появляющиеся вторичные, естественные антикоагулянты - ПДФ и другие отработанные факторы свертывания крови - биологически активные, которые действуют как антиагреганты и антикоагулянты.
В настоящее время различают иммунные тромбофилические осложнения и наследственные дефекты гемостаза.
Система гемостаза при беременности
Доминирует точка зрения, согласно которой в организме беременной женщины создаются определенные условия для развития синдрома диссеминированного внутрисосудистого свертывания. Это выражается в повышении общего коагулянтного потенциала (суммарная активность факторов свертывания), повышении функциональной активности тромбоцитов при некотором снижении их количества, снижении фибринолитической активности при увеличении ПДФ, снижении активности антитромбина III при некотором уменьшении его содержания. Эти особенности носят компенсаторно-приспособительный характер и необходимы как для нормального формирования фетоплацентарного комплекса, так и для ограничения кровопотери в родах. В активации системы гемостаза большую роль играют изменения общей гемодинамики в организме беременной женщины. Для нормального функционирования фетоплацентарной системы в условиях высокого коагуляционного потенциала крови вступают в действие компенсаторно-приспособительные механизмы: увеличение количества терминальных ворсин малого калибра с гиперплазией и периферическим расположением капилляров, уменьшение толщины плацентарного барьера с истончением синцития, образование синцитиокапиллярных мембран, синцитиальных узелков.
Особенности функционирования системы гемостаза связаны с определенными изменениями в системе спиральных артерий матки. Это - инвазия клеток трофобласта в стенку спиральных артерий, замещение внутренней эластичной мембраны и внутренней медии толстым слоем фибрина, нарушение целостности эндотелия и обнажение коллагенновых субэндотелиальных структур. В этом процессе имеет значение и развертывание межворсинчатого пространства с присущими ему морфологическими и гемодинамическими особенностями.
Особенности системы гемостаза при физиологически протекающей беременности определяются формированием маточно-плацентарного круга кровообращения.
Уровень тромбоцитов при неосложненном течении беременности остается практически неизмененным, хотя есть исследования, где отмечено снижение уровня тромбоцитов. При снижении уровня тромбоцитов ниже 150000/ml необходимы исследования для выявления причин развития тромбоцитопении.
При беременности наблюдается возрастание коагулянтного потенциала, организм как бы готовится к возможному кровотечению в процессе родов. Отмечено возрастание всех факторов свертывания за исключением фактора XI и XIII.
Увеличение уровня фибриногена начинается с 3-го месяца беременности и несмотря на увеличение объема циркулирующей плазмы уровень фибриногена в конце беременности увеличивается не менее чем в два раза по сравнению с небеременным состоянием.
Активность фактора VIII (фактора Виллебранда) также увеличивается и не только у здоровых женщин, но и у пациенток - кондукторов гемофилии и больных болезнью Виллебранда. Следует учитывать, что при легкой и среднетяжелой степени этого заболевания уровень этого фактора может быть практически нормальным. В противоположность общего увеличения факторов свертывания отмечено при беременности некоторое снижение XI фактора в конце беременности и более заметное снижение XIII фактора (фибрин-стабилизирующего фактора). Физиологическая роль этих изменений пока не ясна.
Коагуляционный потенциал крови возрастает еще в связи с тем, что снижается уровень антитромбина III, протеин С повышается в основном в послеродовом периоде, а протеин S снижен при беременности и значительно снижен после родов.
При беременности отмечено снижение фибринолиза в конце беременности и в процессе родов. В раннем послеродовом периоде активность фибринолиза возвращается к норме. Относительно присутствия в кровотоке ПДФ в литературе имеются противоречивые данные. По результатам исследования, отмечено небольшое увеличение ПДФ в последние месяцы беременности. По данным иследований, при неосложненном течении беременности увеличения содержания продуктов деградации не обнаруживается вплоть до начала родов. По данным J. Rand и соавт. (1991), уровень некоторых фрагментов продуктов деградации фибрина повышается с 16 недель беременности и достигает плато в 36-40 недель. Однако значительное увеличение ПДФ при беременности скорее всего является отражением фибринолитического процесса в связи с активацией внутрисосудистого свертывания.
Изменение системы гемостаза у беременных с антифосфолипидным синдромом
Показатели системы гемостаза у беременных с антифосфолипидным синдромом существенно отличаются от показателей у женщин с физиологическим течением беременности. С момента наступления беременности у большинства пациенток отмечены изменения тромбоцитарного звена гемостаза. Агрегация тромбоцитов при стимуляции АДФ на 55-33% выше, чем при физиологическом течении беременности. Тенденция к повышению агрегации сохраняется на фоне антиагрегантной терапии.
Агрегация тромбоцитов под действием коллагена в 1,8 раза выше, чем при физиологическом течении беременности. Агрегация тромбоцитов под действием адреналина на 39% выше, чем в группе контроля. Если под влиянием проводимой терапии не удается снизить эти показатели, то такая стойкая гиперактивность тромбоцитов является основанием для увеличения дозы антиагрегантов или назначения дополнительных антиагрегантных средств. Показатели ристомицин - агрегации в среднем в I триместре остаются в пределах нормы. Проведенные исследования показали, что с ранних сроков беременности у пациенток с АФС имеется повышенная реакция тромбоцитов к воздействию биологических индукторов, выявленных в основном в тестах функциональной активности тромбоцитов, таких как агрегация под воздействием АДФ 1х10 3 М и 1х10 5 М, арахидоновой кислотой.
При оценке качественных характеристик по типам агрегатограмм ни в одном наблюдении не отмечено дезагрегации (обратимой агрегации) при воздействии даже слабых стимулов АДФ 1 х10 7 М. Об этом свидетельствует изменение профиля кривых в сторону так называемых «нетипичных» гиперфункциональных агрегатограмм.
Показатели плазменного звена гемостаза в I триместре беременности также изменены по сравнению с контролем: отмечено достоверное ускорение АВР, на тромбоэластограмме укорочен показатель r+k, достоверно выше показатель структурных свойств фибринового сгустка - ИТП.
Таким образом, у беременных с АФС уже в I триместре отмечается умеренная гиперкоагуляция в плазменном звене гемостаза, развивающаяся раньше, чем гиперкоагуляция, связанная с адаптацией гемостаза при физиологически протекающей беременности. Данные изменения, определяющие гиперактивность гемостаза в целом в I триместере беременности не рассматривается как патологическая активация внутрисосудистого тромбообразования, т.к. чрезвычайно редко при этом сроке беременности мы наблюдали появление маркеров ДВС - продуктов деградации фибрина и фибриногена (ПДФ). Содержание ПДФ в I триместре не превышало 2x10 г/л. Это явилось основанием расценивать гиперактивность тромбоцитарного и плазменного звеньев гемостаза, как не соответствующую сроку беременности гиперкоагуляцию и фон для развития ДВС.
Во II триместре беременности, несмотря на терапию, отмечены изменения в плазменном звене гемостаза. Выявлено, что АЧТВ на 10% и АВР на 5% короче, чем при физиологической беременности. Эти данные свидетельствуют о нарастающей гиперкоагуляции. Эта же тенденция отмечена по тромбо-эластограмме: показатели хронометрической коагуляции r+k, параметры Ма и величины ИТП выше, чем при физиологической беременности.
В тромбоцитарном звене гемостаза отмечается статистически достоверное увеличение агрегации и увеличение гиперфункциональных типов кривых при воздействии слабыми стимуляторами, что свидетельствует о стойкой гиперактивности тромбоцитов у беременных с АФС, резистентной к проводимой терапии.
В III триместре беременности отмечена та же тенденция к нарастанию явлений гиперкоагуляции, несмотря на проводимую терапию. Показатели концентрации фибриногена, АВР и АЧТВ, свидетельствуют о развившейся гиперкоагуляции. Хотя в связи с большим контролем гемостазиограмм лечебными мероприятиями удается удержать гиперкоагуляцию в пределах, близких к физиологическим параметрам.
Учитывая, что основные, естественные ингибиторы свертывания крови синтезируются сосудистой стенкой, в том числе сосудами плаценты, большой интерес представляет оценка суммарной активности ингибитора активатора плазминогена (ИАП) по мере прогрессирования беременности у женщин с антифосфолипидным синдромом. Проведенные в динамике беременности определения содержания ИАП показали, что у беременных с антифосфолипидным синдромом отсутствует повышение блокирующего действия ИАП 1 и плацентарного ИАП 2.
Максимальное повышение ингибитора активатора плазминогена в отдельных наблюдениях составило 9,2-9,7 ЕД/мл (в норме этот показатель составляет 0,3-3,5 ЕД/мл) на фоне достаточно высокой активности и содержания плазминогена - основного фибринолитического субстрата (112-115% и 15,3-16,3 г/л, при норме соответственно 75-150% и 8 г/л). Ранние признаки патологической активности системы гемостаза (тромбинемия) в I триместре по уровню неактивного комплекса антитромбина III (TAT) отмечены только в единичных наблюдениях, что подтверждает фактическую внутрисосудистую генерацию прокоагулянтной активности.
Исследования компонентов противосвертывающих механизмов системы гемостаза позволили установить большую вариабельность содержания протеина С (ПрС), в большинстве наблюдений снижение его уровня не зависит от срока беременности. Максимальная активность ПрС не превышала 97%, в большинстве наблюдений - 53-78% (норма 70-140%).
Индивидуальный анализ содержания ингибитора активатора плазминогена во II триместре беременности позволил выявить резкое увеличение ингибитора активатора плазминогена до 75 ЕД/мл только в 1 случае, при этом было сочетание повышения ингибитора активатора плазминогена с выраженной патологией AT III, активность 45,5%, концентрация 0,423 г/л. Во всех остальных наблюдениях содержание ингибитора активатора плазминогена колебалось от 0,6-12,7 ЕД/мл, в среднем 4,7±0,08 ЕД/мл. Далее, в III триместре содержание ингибитора активатора плазминогена также оставалось низким, колебания составляли от 0,8 до 10,7 ЕД/мл, в среднем 3,2± 0,04 ЕД/мл, только в одном наблюдении - 16,6 ЕД/мл. Учитывая, что обычно резкое увеличение содержания ингибитора активатора плазминогена способствует снижению фибринолитической активности и локальному тромбообразованию (за счет подавления репаративного фибринолиза), отмеченные нами факты можно рассматривать как отсутствие реакции эндотелия у беременных с АФС, направленной на синтез эндотелиального компонента ИАП 1, синтезируемого эндотелием сосудистой стенки, и, что более важно, отсутствие системы плацентарного компонента ИАП 2, продуцируемого сосудами плаценты. Возможным объяснением отмеченных нами факторов может быть нарушение функции эндотелиальных клеток и, в первую очередь, сосудов плаценты у беременных с антифосфолипидным синдромом, вероятно, за счет фиксации на эндотелии комплексов антиген-антитело.
Обращает на себя внимание существенное снижение активности ПрС во II триместре беременности на 29% ниже, чем в контрольной группе.
Оценка фибринолитической системы показала следующие результаты: активность плазминогена в большинстве наблюдений была высокой в I триместре 102±6,4%и концентрация 15,7±0,0Эг/л; во II триместре активность плазминогена была подвержена еще большим колебаниям от 112до 277% и концентрация от 11,7 г/л до 25,3 г/л, в среднем 136,8+11,2% концентрация 14,5+0,11 г/л. В III триместре сохранились аналогичные состояния: активность плазминогена колебалась от 104 до 234% (норма 126,8±9,9%) концентрация от 10,8до 16,3 г/л, в среднем 14,5+0,11 г/л. Таким образом, фибринолитический потенциал у беременных с антифосфолипидным синдромом достаточно высокий.
В противовес этому содержание основного ингибитора фибринолиза альфа2-макроглобулин (альфа 2Мд) было достаточно высоким в I триместре беременности, колебалось от 3,2 до 6,2 г/л (в норме 2,4 г/л), в среднем 3,36±0,08 г/л; во II триместре соответственно от 2,9 до 6,2 г/л, в среднем 3,82±0,14 г/л.
Аналогичные данные получены относительно содержания альфа1-антитрипсина (альфаlAT), которое во все триместры беременности составляло от 2,0 до 7,9 г/л. Поскольку CL-Mg и a1-AT относятся к буферным ингибиторам замедленного и непрямого действия, их влияние на активацию фибринолитической системы, даже в условиях высокого содержания плазминогена, проявилось снижением фибринолитического потенциала у беременных с антифосфолипидным синдромом, аналогичное таковому при физиологическом течении беременности.
Перечисленные особенности системы гемостаза подчеркивают большую значимость контрольных исследований гемостаза при беременности для оптимизации противотромботической терапии и профилактики ятрогенных осложнений.
Исследование системы гемостаза перед родами показало, что остается сохранным гемостатическии потенциал и несмотря на антиагрегантную терапию сохраняется тенденция к гиперфункции тромбоцитов.
Учитывая, что пациентки с антифосфолипидным синдромом в процессе беременности получают антитромботические средства, а после родов имеется большой риск тромбэмболических осложнений, присущих больным с антифосфолипидным синдромом, чрезвычайно актуальным является исследование гемостаза в послеродовом периоде.
Недооценка гемостазиограмм, прекращение терапии сразу после родов может вести к быстро развивающейся гиперкоагуляции и тромбэмболическим осложнениям. Исследования показали, что после родов остается высоким потенциал свертывания крови, даже в тех наблюдениях, где пациентки получали гепаринотерапию. Исследования системы гемостаза целесообразно проводить на 1, 3 и 5 сутки после родов. Отмечена умеренная гиперкоагуляция у 49% родильниц, а у 51% родильниц отмечена активация системы гемостаза - нарастание гиперкоагуляции и появление ПДФ.
Врожденные дефекты гемостаза
В настоящее время уделяется большое внимание генетически детерминированным формам тромбофилии, которые подобно антифосфолипидному синдрому сопровождаются тромбоэмболическими осложнениями при беременности и ведут к потере беременности на любом ее этапе. Основные причины наследственной тромбофилии: дефицит антитромбина, протеина С и S, гепарин-кофактора Н, дефицит фактора ХII, дис- и гипоплазминогенемия, дисфибриногенемия, дефицит тканевого активатора плазминогена, Лейденовская мутация гена V фактора свертывания крови.
Помимо этих нарушений в последние годы относят к наследственным тромбофилическим состояниям гипергомоцистеинемию - состояние, при котором из-за наследственного дефекта энзима метилентетрагидрофолат-редуктазы имеется риск развития венозных и артериальных тромбозов и в связи с этим - потеря беременности с возможным ранним развитием эклампсии. Следует отметить, что в одной из последних публикаций отмечено, что гипергомоцистеинемия выявлена у 11% популяции европейцев. В отличие от других наследственных дефектов гемостаза при этой патологии наблюдаются ранние потери беременности уже в I триместре. При гипергомоцистеинемии весьма эффективной профилактикой тромбозов является применение фолиевой кислоты.
При выявлении беременных с наследственными тромбофилиями необходима очень внимательная оценка данных анамнеза семьи. При наличии в анамнезе у ближайших родственников тромбоэмболических осложнений в молодом возрасте, при беременности, при употреблении гормональной терапии, в том числе, оральных контрацептивов, необходимо обследование на наследственные дефекты гемостаза, при которых чрезвычайно высок риск тромбоэмболических осложнений.
Антитромбин инактивирует тромбин, факторы IXa, Xa, XIa и ХПа. Дефицит альфа1-антитромбина высоко тромбогенный и дает до 50% случаев тромбозов при беременности. В связи с гетерогенностью нарушений частота встречаемости этого дефекта варьирует от 1:600 до 1:5000.
Протеин С инактивирует факторы Va и VIIIa. Протеин S действует как кофактор протеина С, усиливая его действие. Дефицит протеина С и S встречается с частотой 1:500. Протеин С при беременности практически не изменяется, протеин S снижается во второй половине беременности и возвращается к норме вскоре после родов. Поэтому, если определение протеина S будет проводиться при беременности, можно получить ложно-положительные результаты.
В последние годы много публикаций о тромбофилии вследствие мутации гена V фактора, это - так называемая Лейденовская мутация. В результате этой мутации протеин С не влияет на V фактор, что и ведет к тромбофилии. Эту патологию находяту 9% европейской популяции. Эта мутация должна быть подтверждена исследованием ДНК для фактора V Leiden. Частота встречаемости Лейденовской мутации значительно варьирует. Так, по данным шведских исследователей, частота встречаемости этого дефекта гемостаза среди беременных с тромбозами составила от 46 до 60%, в то время как в Англии - только 14% и в Шотландии - 8%.
Нарушения гемостаза
Комплекс факторов и механизмов, обеспечивающих оптимальное агрегатное состояние агрегатного состояния крови.
Для оценки свертывающей системы крови проводят тесты:
Время, длительность кровотечения. Прокол пальца и выступающую каплю обмакивают в бумажку. Норма – 45-180секунд.
Время свертывания крови по Ли-Уайту. Берут в пробирку и раскачивают до появления нитей фибрина. Норма – 6-9 минут.
В ответ на повреждение сосудов происходит спазм сосудистой стенки. К поврежденному сосуду устремляются тромбоциты, они прилипают к сосудистой стенки (адгезия). Склеиваются и образуется тромбоцитарный тромб. Эти механизмы – сосудисто-тромбоцитарный гемостаз.
Фаза свертывания крови.
Коагуляционный гемостаз. Его активация может происходить по 2 путям:
Механизм – внутренний, активируется с помощью коллагена, протеазы или адреналина, эти факторы приводят к тому, что: XII фактор Хагемана превращается в активный белок, при активации (аминокислотная группа отваливается и она – активная форма) XIIa XI IX VIII – обязательно при участии ионов Ca образование активной протромбиназы (тромбопластина).
Механизм – внешний – повреждение тканей. Тканевой тромбопластин (III) способствует переходу VII фактора в активную форму и результат – образование активной протромбиназы.
В 1 фазу свертывания крови учавствуют – 7, 8, 9 факторы свертывания.
Свертывания крови.
Активная протромбиназа (тромбокиназа) переходит в тромбин. Имеет 2 подфазы:
Образование ферментативной дозы тромбина.
Под действие запальной дозы тромбина проконвертин (VII) переходит к конвертин (VIIa). Конвертин возвращает процесс свертывания в 1 фазу
Проакцелирин (V) переходит в акцелерин (Va) – ускоряет свертывание крови.
Образование результирующей дозы тромбина. Работают протромбин, проакцелирин, проконвертин.
Тромбин воздействует на фибрин, образуя фибриноген. Полимеризация и стабилизация. Фибриноген – фибриномомномер – фибринолигомеры – фибринполимеры.
Фаза – фибринолиз.
XII XIIa плазминоген – плазмин (основной фактор фибринолитической системы) фибрин разрушается до продуктов деградации фибрина (продукты фибринолиза активируют 1 фазу свертывания).
Система гемостаза.
Геморрагические диатезы.
Разделяются в зависимости от повреждения компонента гемостаза:
Вазопатии:
Наследственные:
телеангиэктазия или болезнь Рандю-Ослера – наследуется аутосомно-доминантно, т.е дефект структуры сосудистой стенки, она истончается и образуются мешкообразные эктазы. Локализация: губы, верхняя часть туловища, лицо, волосистая часть головы, на слизистой оболочке, в полостях. Эти истонченные стенки хорошо травмируются. У пациента формируется хроническая анемия железодефицитная вследствие хронической кровопотери.
Приобретенные:
Гиповитаминозы С (цинга), РР – необходимы для полимеризации стенки сосудов – у пациента образуются петехии, васкулит. На симметричных участках кожи.
Геморрагичсекий васкулит (болезнь Шенлейна-Геноха):
Пробы на резистентность сосудистой стенки: Кончаловского (до определенного значения нагнетается давления в манжете, затем подсчитывается количество петехий), жгута (после наложения манжеты при измерении АД, смотрят на кожу – будут кровоизлияния), щипка (ущипнуть кожу).
Тромбоцитопатии:
Тромбоцитопении:
Болезнь Верльгофа (тромбоцитопеническая пурпура) – наследуется аутосомно-доминантно. Проявляется в виде синяков, причем цветут – кожа леопарда.
По наследству передается способность селезенки вырабатывать ингибитор тромбоцитопоэза (селезеночный фактор). Этот фактор ингибирует отшнуровку тромбоцитов от мегакариоцитов в костном мозге, количество мегакариоцито возрастает, а толку от них мало.
Лечат: удалением селезенки.
Приобретенные: НА ТЕЛЕФОНЕ ФОТО!
Миелотоксическое воздействие:
Экзогенные факторы: физические (ионизирующая радиация), химические (цитостатики, антибиотики, продукты нефтепереработки), биологические (вирусы, токсины микроорганизмов).
Эндогенные:
Угнетение нормальных ростков кроветворения.
Аутоиммунная тромбоцитопения.
Результат – носовые, десневые кровотечения, маточные, синяки.
Для дифференцировки существует биопроба, животному вводится сыворотка больного. Селезеночный фактор не обладает видоспецифичностью, поэтому он вызывает тромбоцитопению и у животного.
Тромбоцитастении – нарушение функциональных свойств тромбоцитов:
Наследственные: болезнь Гланцмана, болезнь Виллебранда (комплексный геморрагический диатез, потому что эндотелий в норме вырабатывает фактор Виллебранда, составную часть 8 фактора,. А по наследству передается извращенный синтез этого фактора. Фактор Виллебранада – фактор коагуляции).
Приобретенные:
Переливание больших доз крови, плазмы, концентратов прокоагулянтов.
Миеломная болезнь, болезнь Вальденстрема (повышение в поазме нормальных и аномальных белков).
ДВСС (повышение ПДФ – продукты деградации фибрина)
Лекарственные - НПВС
Гиповитаминоз С, В 12 .
Механизм тромбоцитоастений:
Нарушение синтеза и накопление в гранулоцитах тромбоцитов БАВ,
Нарушение дегрануляции и высвобождения тромбоцитарных факторов в плазм крови.
Диагностика тромбоцитопений и астений:
Количество тромбоцитов: 180-400*10 9 /л.
Время агрегакции тромбоцитов: 14-18 сек
Процент клеток, вступивших в агрегацию – более 90.
Удлинение времени и уменьшение клеток вступивших – тромбоциастения.
Положительная проба Кончаловского – тромбоциты определяют трофику эндотелия сосудов, выделяют факторы роста необходимы для эндотелиоцитов. Если тромбоцитов мало – дефекты, ломкость сосудов повышается.
Коагулопатии – нарушение коагуляционного гемостаза:
Наследственные. По фазам свертывания:
Нарушение I фазы свертывания:
Гемофилия А (80% сех гемофилий) – дефицит VIII фактора.
Гемофилия В (10%) – дефицит IX фактора.
Гемофилия С (5%) – дефицит XI фактора.
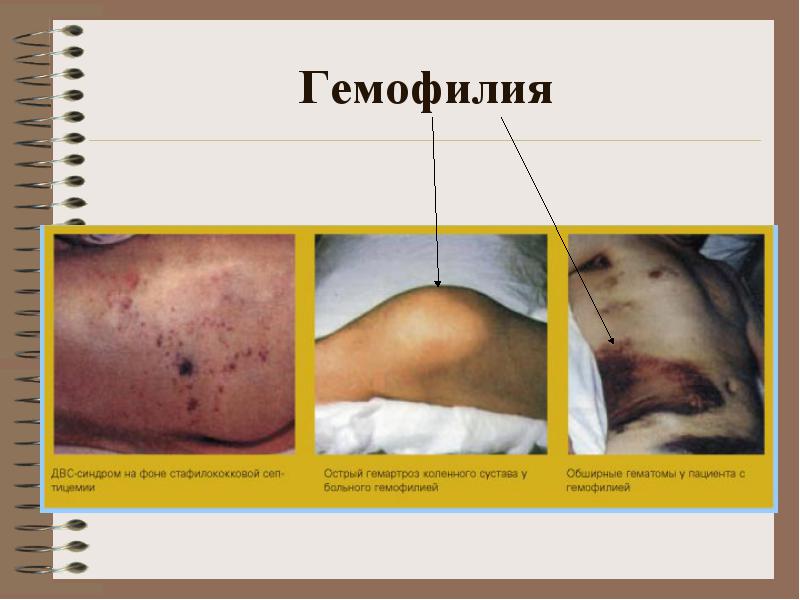
Механизм наследования гемофилии: гемофилия А – это дефект X хромосомы. Здоровый отец, мама – носитель: здоровый сын, здоровая дочь, дочь-носитель, страдающий гемофилией сын. Заболевание проявляется сразу после рождения, у новорожденного возможны различные кровоизлияния (кефалогематома). Любая травма приводит к образованию гематом (тип кровоизлияния). Возможно формирование гемартрозов.
В и С гемофилии могут быть и у мужчин и у женщин.
Диагностика нарушений I фазы свертывания:
Активированное время рекальцификации плазмы (АВР) 40-60сек.
Активированное частично тромбопластиновое время (АЧТВ) 33-45сек.
Нарушение II фазы:
Наследственные (парагемофилии): гипопротромбинемия, гипопроконвертинемия, гипопроакцелеринемия.
Приобретенные: печеночная недостаточность, ахолия, гиповитаминоз К.
Чтобы оценить состояние II фазы оцениваем протромбиновый индекс (ПТИ) 85-110%.
Нарушение III фазы:
Наследственные: гипофибриногенемия, афибриногенемия, дисфибриногенемия.
Приобретенные в результате либо в уменьшении синтеза, или повышенное потребление (особенно при ДВСС): гипофибриногенемия, афибриногенемия.
Ключевые понятия нарушения гемостаза:
1. Нарушения гемостаза, коагулопатия
(coagulopathia, коагуло- + греч. patos – страдание,болезнь) – нарушение функции свёртывающей и противосвёртывающей систем крови.
2. Гиперкоагуляционно-тромботическое состояние
– состояние, сопровождающееся патологическим процессом усиления свёртываемости крови вследствие повышенной агрегации тромбоцитов, активации плазменных и тканевых факторов свёртывания крови с образованием тромбоцитарного и фибринового сгустков.
3. Гипокоагуляционно-геморрагическое состояние
– состояние, сопровождающееся патологическим процессом уменьшения свёртываемости крови вследствие снижения агрегации тромбоцитов, инактивации плазменных и тканевых факторов свёртывания крови с возникновением кровоточивости и кровотечений.
4. ДВС-синдром (тромбо-геморрагическое состояние)
– синдром диссеминированного внутрисосудистого свёртывания крови – типический патологический процесс нарушения гемостаза в результате последовательно протекающих реакций свёртывания крови: гиперкоагуляции (образование диссеминированных тромбов в микроциркуляторной сосудистой сети) и гипокоагуляции (истощение тромбогенных факторов и усиление фибринолиза), сопровождающихся массивным кровотечением, тяжёлым гемокоагуляционным шоком и острой дистрофией внутренних органов.
При каких заболеваниях возникает нарушение гемостаза:
Гемостаз - это сложный процесс, который предотвращает или останавливает истечение крови из просвета сосуда, обеспечивает возникновение свертка фибрина, необходимого для восстановления целостности ткани, и, наконец, удаляет фибрин, когда нужда в нем отпадает. В этом процессе участвуют четыре основных физиологических механизма.
С помощью системы гемостаза кровь выполняет свою важнейшую функцию - поддержание жидкого состояния крови, протекающей в кровеносных сосудах, и свертывание крови при нарушении целостности сосудистой стенки и, тем самым, прекращение кровотечения и сохранение объема и состава крови. Система гемостаза многокомпонентна. В ней участвуют тромбоциты и другие клетки крови, сосудистая стенка, экстраваскулярная ткань, биологически активные вещества (тромбоцитарно-сосудистый гемостаз), плазменные, тканевые факторы свертывания крови (коагуляционный гемостаз), находящиеся в тесном взаимодействии с противосвертывающей, фибринолитической и калликреин-кининовой системами. Нарушение любого из этих компонентов ведет к патологии гемостаза.
Классификация нарушения гемостаза. Патология гемостаза классифицируется по преимущественному поражению различных его компонентов на нарушения тромбоцитарно-сосудистого гемостаза и коагуляционного гемостаза. По этиологии эти нарушения могут быть приобретенными и наследственными, а по направленности изменений подразделяться на понижение свертывания крови (гипокоагуляцию) и повышение свертывания крови (гиперкоагуляцию), которое может быть локальным (тромбоз) и генерализованным (ДВС-синдром).
Понижение свертывания крови
Понижение свертывания крови проявляется повышенной кровоточивостью (геморрагическим синдромом) - повторными кровотечениями, кровоизлияниями, возникающими как самопроизвольно, так и при незначительных травмах.
Тромбоцитарно-сосудистый гемостаз нарушается при количественных и качественных изменениях тромбоцитов (тромбоцитопениях и тромбоцитопатиях), а также поражениях сосудистой стенки.
Тромбоцитопенией называется уменьшение содержания тромбоцитов в крови ниже нормы (180-320 Г/л или 180-320x109/л). Однако спонтанные кровотечения возникают лишь при снижении их числа меньше 30 Г/л. Под тромбоцитопатиями понимают качественную неполноценность и дисфункцию тромбоцитов при нормальном или пониженном их содержании.
Причины пониженного свертывания крови. Причиной возникновения тромбоцитопении нередко являются иммунные реакции при изменении антигенной структуры тромбоцитов под действием вирусов, лекарственных препаратов, выработке антитромбоцитарных аутоантител (при хроническом лимфолейкозе, идиопатической тромбоцитопении), несовместимости тромбоцитарных антигенов матери и плода. Кроме того, тромбоцитопения развивается вследствие поражения мегакариоцитарного ростка костного мозга ионизирующей радиацией, химическими веществами или вытеснения его опухолевыми метастазами, лейкозными инфильтратами. Снижение тромбоцитопоэза может быть обусловлено дефицитом цианокобаламина и фолиевой кислоты, наследственным дефектом образования тромбоцитов (в том числе при дефиците тромбоцитопоэтинов). Тромбоцитопения возникает в результате механического повреждения тромбоцитов при спленомегалии, искусственных клапанах сердца, а также усиленного потребления тромбоцитов при локальном и генерализованном внутрисосудистом свертывании крови.
К этиологическим факторам, вызывающим тромбоцитопатию, относятся действие токсических веществ и лекарственных препаратов (алкоголь, ацетилсалициловая кислота), ионизирующей радиации, эндогенных метаболитов (при уремии, циррозе печени); дефицит цианокобаламина, гормональные нарушения (гипотиреоз). Наблюдаются и генетические дефекты структуры мембраны и биохимического состава тромбоцитов (дефицит тромбостенина, фактора 3, АТФ, АДФ, Г-6-ФДГ, мембранных рецепторов для факторов V, VIII, XI и др.).
При геморрагических вазопатиях поражение сосудистой стенки, приводящее к нарушению тромбоцитарно-сосудистого гемостаза и кровоточивости, возникает вследствие повышения проницаемости стенки кровеносных сосудов и ее деструкции при нарушении синтеза коллагена (при алиментарном дефиците аскорбиновой кислоты, наследственных дефектах синтеза коллагена), при действии биологически активных веществ (аллергия), радиотоксинов (лучевая болезнь), иммунных геморрагических васкулитах, снижении ангиотрофической функции тромбоцитов при тромбоцитопениях и тромбоцитопатиях, разрушении сосудистой стенки лейкозными инфильтратами. Одной из причин кровоточивости является уменьшение выработки эндотелием сосудистой стенки фактора Виллебранда - крупномолекулярного компонента VIII фактора свертывания-крови (наследственная болезнь Виллебранда). Этот фактор накапливается в тромбоцитах и освобождается при их дегрануляции.
Он необходим для нормальной адгезии тромбоцитов к коллагену стенки, и без него не формируется тромбоцитарный тромб. Геморрагический синдром наблюдается и при усилении перекисного окисления мембранных фосфолипидов, в результате чего в эндотелии синтезируется и секретируется избыточное количество мощных ингибиторов агрегации тромбоцитов - простациклинов. Кроме того, к снижению тромбоцитарно-сосудистого гемостаза приводит нарушение нейрогенной и гуморальной регуляции сосудистого тонуса, понижение которого ведет к невозможности закупорки мелких сосудов тромбоцитарным тромбом.
Патогенез пониженного свертывания крови. Выделяют четыре основных механизма возникновения тромбоцитопений: уменьшение продукции, усиленное разрушение, повышенное потребление (тромбообразование), перераспределение тромбоцитов.
Нарушение гемостаза и развитие кровоточивости при тромбоцитопении обусловлено следующими механизмами:
- повышением проницаемости микрососудов для эритроцитов и других составных частей крови (диапедезная геморрагия) и ломкости сосудов вследствие дистрофии стенки при выключении ангиотрофической функции тромбоцитов;
- уменьшением адгезивно-агрегационной функции тромбоцитов;
- нарушением реакции освобождения тромбоцитарных факторов свертывания крови, АДФ, серотонина, адреналина, антигепаринового фактора, следствием чего является недостаточное формирование тромбоцитарного тромба, отсутствие спазма сосудов и замедление свертывания;
- уменьшением ретракции сгустка в результате снижения активности сократительного белка тромбоцитов - тромбостенина (фактор 8 тромбоцитов).
В патогенезе тромбоцитопатий можно выделить два основных механизма их возникновения - продукция патологических тромбоцитов в костном мозге и деструкция тромбоцитов во всех отделах системы крови. Патогенез нарушения тромбоцитарно-сосудистого гемостаза при тромбоцитопатиях такой же, как и при тромбоцитопениях, так как связан с выключением функций тромбоцитов.
Нарушение коагуляционного гемостаза, приводящее к развитию кровоточивости, может быть вызвано следующими факторами:
- приобретенным и наследственным уменьшением или извращением синтеза плазменных и тромбоцитарных факторов свертывания крови и компонентов калликреин-кининовой системы;
- ингибированием или повышенным потреблением этих факторов;
- увеличением эндогенных антикоагулянтов;
- активизацией фибринолитической системы;
- передозировкой антикоагулянтов, фибринолитических и дефибринирующих препаратов. Все это лежит в основе нарушения одной из трех фаз свертывания крови и ретракции сгустка или же сочетанного их изменения.
Причинами нарушения первой фазы свертывания крови - образования тромбопластина - является снижение продукции факторов (IX, X) при патологии печени, образование антител к некоторым факторам (VIII, IX) при заболеваниях, в патогенезе которых имеется аутоиммунный компонент (лейкозы, коллагенозы), или же передозировка такого универсального антикоагулянта, как гепарин. Известны генетические дефекты синтеза VIII, IX и XI факторов, дефицит которых лежит в основе развития гемофилии (соответственно последовательности этих факторов - гемофилии А, В и С).
Нарушение второй фазы свертывания крови - образования тромбина - возникает не только при заболеваниях печени, но и при гипо- и авитаминозах К, когда тоже понижается синтез в печени факторов II, V, VII, участвующих в этой фазе (при механической желтухе, энтерите, обширной резекции тонкой кишки, лекарственном дисбактериозе). Возможно появление иммунных ингибиторов факторов V, VII (например, при лечении стрептомицина сульфатом), усиленное их выведение почками, наследственный дефицит (фактора V при парагемофилии) или же инактивация компонентами противосвертывающей системы - антитромбинами, гепарином (при анафилактическом шоке, передозировке гепарина).
Геморрагический диатез, связанный с нарушением третьей фазы свертывания - фазы образования фибрина, возникает при уменьшении синтеза фибриногена в пораженных патологическим процессом печени, легких или же в результате наследственной гипо-, афибриногенемии и дефицита фибринстабилизирующего фактора (фактора XIII). Однако значительно чаще нарушение третьей фазы является следствием усиления фибринолиза при травме (операции) легких, матки, поджелудочной железы; ожоге, шоке. Это обусловлено повышенным поступлением в кровь активаторов профибринолизина (плазминогена) - тканевых, микробных фибринокиназ, лейко- и эритроцитарных активаторов, компонентов калликреин-кининовой системы и системы комплемента комплексов гепарина с фибриногеном, профибринолизином и адреналином (эти комплексы обеспечивают неферментативный фибринолиз, по Б. А. Кудряшову).
Патогенез. Главными звеньями в патогенезе геморрагического диатеза, развившегося при нарушении любой из фаз свертывания крови, являются хроническая кровопотеря и ее последствия, а также структурные и функциональные изменения в месте кровоизлияний (в суставах, внутренних органах, коже и других тканях).
Повышение свертывания крови
Повышение свертывания крови проявляется локальным (тромбоз) или генерализованным внутрисосудистым свертыванием крови, в основе чего лежит нарушение тромбоцитарно-сосудистого и коагуляционного гемостаза.
Гиперкоагуляция может быть обусловлена:
- повышением функциональной активности системы свертывания крови за счет увеличенного - - поступления в кровь прокоагулянтов и активаторов свертывания крови;
- увеличением в крови содержания тромбоцитов;
- снижением антитромботических свойств сосудистой стенки;
- уменьшением активности противосвертывающей системы крови;
- ослаблением фибринолиза.
Генерализованное (диссеминированное) внутрисосудистое свертывание крови (ДВС-синдром) - тяжелое нарушение гемостаза, возникающее при избыточном поступлении в кровь прокоагулянтов и активаторов свертывания крови, что ведет к образованию множественных микротромбов в сосудах микроциркуляторного русла, а затем развитию гипокоагуляции, тромбоцитопении и геморрагии в результате "потребления" факторов системы свертывания и повышения функциональной активности системы противосвертывания и фибринолиза крови с последующим истощением всех трех систем.
Этиология. Универсальность и неспецифичность ДВС-синдрома обусловлены многообразием причинных факторов его возникновения. К ним относятся прежде всего генерализованные инфекции и септические состояния, все виды шока, травматические хирургические операции, акушерская патология (преждевременная отслойка, ручное отделение плаценты), острый внутрисосудистый гемолиз, уремия при почечной недостаточности, все терминальные состояния.
Патогенез. Главным звеном в патогенезе генерализованной гиперкоагуляции является нарушение баланса между калликреин-кининовой, свертывающей, противосвертывающей и фибринолитической системами крови при поступлении в сосудистое русло большого количества прокоагулянтов и их активаторов. Это и приводит к нарушению столь важной функции крови, как сохранение ее нормального агрегатного состояния, в результате чего в фазу гиперкоагуляции кровь в сосудах свертывается и прекращается ее циркуляция с развитием тяжелых дистрофических и функциональных нарушений в органах и тканях, нередко несовместимых с жизнью. В последующую фазу гипокоагуляции разжижение крови и потеря способности к свертыванию и агрегации тромбоцитов вызывают кровотечение, которое плохо поддается терапевтической коррекции. При благоприятном исходе наступает третья - восстановительная фаза, при которой происходит нормализация гемостаза.

ПАТОФИЗИОЛОГИЯ СИСТЕМЫ ГЕМОСТАЗА
Значение системы гемостаза
1. Сохранение крови в жидком состоянии (адекватное соотношение активности свертывающей и противосвертывающей систем)
2. Предупреждение и остановка кровотечения (поддержание постоянного объема циркулирующей крови)

ВИДЫ ГЕМОСТАЗА
СОСУДИСТО-ТРОМБОЦИТАРНЫЙ
(ПЕРВИЧНЫЙ)
- ОСТАНОВКА КРОВОТЕЧЕНИЯ В МИКРОСОСУДАХ
КОАГУЛЯЦИОННЫЙ
(ВТОРИЧНЫЙ)
ФОРМИРОВАНИЕ ФИБРИНОВЫХ СГУСТКОВ

КОМПОНЕНТЫ СИСТЕМЫ ГЕМОСТАЗА
* СОСУДИСТАЯ СТЕНКА
* ТРОМБОЦИТЫ (моноциты, эритроциты)
* ПЛАЗМЕННЫЕ СИСТЕМЫ :
- ПРОКОАГУЛЯНТЫ
- АНТИКОАГУЛЯНТЫ
- ФИБРИНОЛИТИЧЕСКАЯ
- КАЛЛИКРЕИН-КИНИНОВАЯ

КЛАССИФИКАЦИЯ НАРУШЕНИЙ ГЕМОСТАЗА
ЗА ЭТИОЛОГИЕЙ
- НАСЛЕДСТВЕННЫЕ
- ПРИОБРЕТЕННЫЕ
ЗА МЕХАНИЗМОМ РАЗВИТИЯ
- НАРУШЕНИЯ СОСУДИСТО-ТРОМБОЦИТАРНОГО
ГЕМОСТАЗА
- НАРУШЕНИЯ КОАГУЛЯЦИОННОГО ГЕМОСТАЗА
ЗА НАПРАВЛЕННОСТЬЮ ИЗМЕНЕНИЙ
- ГИПОКОАГУЛЯЦИЯ
- ГИПЕРКОАГУЛЯЦИЯ

ГИПОКОАГУЛЯЦИЯ
Снижение способности крови сворачиваться с появлением склонности к повторным кровотечениям и кровоизлия-ниям (спонтанным или после незначительных травм)

ЭТИОЛОГИЯ
1. ТРОМБОЦИТОПЕНИЯ
2. ТРОМБОЦИТОПАТИЯ
3. ВАЗОПАТИЯ
4. КОАГУЛОПАТИЯ

ТРОМБОЦИТОПЕНИЯ
Патологическое состояние которое характеризуется понижением содержания тромбоцитов в крови (меньше 150·109 /л)

НАСЛЕДСТВЕННАЯ ТРОМБОЦИТОПЕНИЯ
Как правило, одновремен-но сопровождается врож-деннными дефектами тромбоцитов

ПРИОБРЕТЕННАЯ ТРОМБОЦИТОПЕНИЯ (КЛАССИФИКАЦИЯ ЗА МЕХАНИЗМОМ РАЗВИТИЯ)
ПОВРЕЖДЕНИЕ ТРОМБОЦИТОВ
- имунными комплексами
- механическая травматизация (спленомегалия, гемангиома)
УГНЕТЕНИЕ ОБРАЗОВАНИЯ ТРОМБОЦИТОВ
(апластическая анемия, химическое и радиационное повреждение красного костного мозга, замещение кроветворной ткани опухолью)
ПОВЫШЕННОЕ ИСПОЛЬЗОВАНИЕ ТРОМБОЦИТОВ
(тромбоз, ДВС-синдром)

ИММУННАЯ ТРОМБОЦИТОПЕНИЯ
ГЕТЕРОИММУННАЯ
* Возникает чаще у детей
** Причина – изменение антигенной структуры тромбоцитов (при оседании вирусов краснухи, оспы, аденовирусов; гаптенов медикаментозного происхождения – хинидин, сульфаниламиды, рифампицин; вакцины)
***Течение благоприятное (при устранении причины наступает полное выздоровление)

ИММУННАЯ ТРОМБОЦИТОПЕНИЯ
АУТОИММУННАЯ
Возникает чаще у взрослых
Причина – отсутствие иммунной толерант-ности к антигенам собственных тромбоцитов
Провоцирующие факторы: лекарства, вирусы, бактерии

Аутоиммунная тромбоцитопения
БОЛЕЗНЬ ВЕРЛЬГОФА
(аутоиммунная хроническая тромбоцитопеническая пурпура)
* На поверхности тромбоцитов количество Ig G увеличивается в 10 раз
* Основным местом синтеза Ig G является селезенка
* Принцип лечения :
- спленэктомия
- кортикостероиды
- иммунодепресанты
* Полного излечения не бывает


ТРОМБОЦИТОПАТИЯ
Нарушенние гемостаза вследствие качественной неполноценности или дисфункции тромбоцитов, которое характеризуется нарушением сосудисто-тромбоцитарного гемостаза, появлением кровоточи-вости тканей и органов

БЕЗ НАРУШЕНИЯ РЕАКЦИИ ОСВОБОЖДЕНИЯ ГРАНУЛ
Тромбастения Гланцмана
*Наследование - аутосомно-рецессивное
*Причина - отсутствие гликопротеидов 2в и 3а в оболочке тромбоцитов
*Патогенез - тромбоциты не взаимодей-ствуют с фибриногеном и не агрегируют
*Признаки: петехии, носовые кровотече-ния, маточные кровотечения (могут быть смертельными!! )

Наследственная тромбоцитопатия
С НАРУШЕНИЕМ РЕАКЦИИ ОСВОБОЖДЕНИЯ ГРАНУЛ
Наследование - аутосомно-рецессивное
Причина – нарушение активности циклоксигена-зы, низкая активность контрактильных белков
Патогенез – отсутствие агрегации при взаимодействии с коллагеном, отсутствие освобождения гранул
Признаки:

Наследственная тромбоцитопатия
С НАРУШЕНИЕМ НАГРОМОЖДЕНИЯ И ОСВОБОЖДЕНИЯ СОДЕРЖИМОГО ГРАНУЛ
Болезнь Херджманского-Пудлака (АР)
* Причина – нарушение накопления плотных гранул (АДФ, адреналин, серотонин, Са2+)
* Патогенез – отсутствует агрегация при взаимодей-ствии с коллагеном, отсутствует освобождение содержимого гранул
* Признаки: петехии, носовые кровотечения, маточные кровотечения

Наследственная тромбоцитопатия
С НАРУШЕНИЕМ АДГЕЗИИ И АГРЕГАЦИИ ТРОМБОЦИТОВ
Синдром Виллебранда-Юргенса (АР)
Причина – дефицит фактора Виллебранда
Патогенез – нарушена адгезия тромбоцитов вследствие дефицита фактора 8
Болезнь Бернара Сульє (АР)
Причина – отсутствие гликопротеида 1 на тромбоцитах
Патогенез – нарушено взаимодействие тромбоцитов с фактором Виллебранда, ф. 5, ф. 11
Признаки – капиллярные кровотечения (особенно опасны при половом созревании или родах)

Наследственная тромбоцитопатия
ДЕФИЦИТ И СНИЖЕННАЯ ДОСТУПНОСТЬ ф.3
Тромбоцитопатия Боуе и Овена
Причина - дефицит ф.3 тромбоцитов
Патогенез – отсутствует взвємодействие тромбоцитов и прокоагулянтов
Признаки: петехии, носовые кровотечения, маточные кровотечения

Наследственная тромбоцитопатия
Тромбоцитопатии в сочетании сдругими наследственными аномалиями
Синдром Вискотта-Олдриджа
- Причина – в тромбоцитах мало плотных гранул (АДФ, серотонин, адреналин, Са2+), альфа-гранул (бета-тромбоглобулин, фибриноген, фибронектин, ростовой фактор)
- Патогенез –сниженная адгезия и агрегация тромбо-цитов, нарушено освобождение гранул
- Признаки: геморрагический синдром появляєтся рано, могут быть смертельные кровотечения

Приобретенная тромбоцитопатия (Этиология)
1. Лейкозы - мало гранул в тромбоцитах вследствие ускоренного созревания, снижена адгезия и агрегация
2. Нагромождение Ig М – повреждение рецепторов иммунными комплексами, нарушение взаимодействия тромбоцитов с прокоагулянтами (иммунные болезни)
3. Гиповитаминоз В12 – нарушено освобождение гранул
4. Медикаментозные влияния

Медикаментозная тромбоцитопатия
* Ингибиторы синтеза тромбоксана А2
-стероидные противовоспалительные препараты
- нестероидные противовоспалительные препараты (аспирин блокирует агрегацию тромбоцитов на 4-6 дней)
* Стимуляторы образования цАМФ
-папаверин
-эуфиллин
-анаболические стероиды
* Антагонисты ионов Са
-верапамил
-коринфар

ВАЗОПАТИЯ
Геморрагический диатез обусловленный функциональной и морфологической неполноцен-ностью сосудистой стенки
- врожденная
- приобретенная

ВРОДЖЕННАЯ ВАЗОПАТИЯ
Бол. Рандю-Ослера (геморрагическая телеангиоэктазия)
Бол. Фабри (диффузная ангиокера-тома туловища)
Наследственный тромбоцитопени-ческий микроангиоматоз

ВРОДЖЕННАЯ ВАЗОПАТИЯ
Причина – наследственное нарушение развития соединительной ткани, в т.ч. субэндотелия сосудов
Характеристика
- очаговое истончение сосудов
- расширение просвета микрососудов
- мало коллагеновых волокон в субэндотелии
- сосуды легко травмируються
- слабкая адгезия и агрегация тромбоцитов вследствие дефицита коллагеновых волокон
**Признаки – кровотечения носовые, легочно-бронхиальние и желудочно-кишечные (бывают смертельные)

ПРИОБРЕТЕННАЯ ВАЗОПАТИЯ
1. Идиопатическая (саркома Капоши)
- этиология – неизвестна
2. Застойная (дерматит Клотца, дерматит Фавра-Ракушо)
- этиология – хр.сердечная недостаточность, локальная венозная недостаточность
3. Дистрофическая
Стероидная пурпура - гиперфункция надпочечников, лечение кортикостероидами – угнетают синтез коллагена
Скорбут – дефицит вит.С
Бол.Шенляйн-Геноха – повреждение сосудов иммунными комплексами
4. Неврогенная
Клинические признаки – кожные формы кровоточивости


КОАГУЛОПАТИЯ
Геморрагический диатез, который возникает в результате патологии коагуляционной системы гемостаза
** наследственная
** приобретенная

НАСЛЕДСТВЕННАЯ КОАГУЛОПАТИЯ
Генетически обусловленное нарушение свертывания крови вследствие дефицита или молекулярной аномалии веществ, отвечающих за коагуляционный гемостаз

НАСЛЕДСТВЕННАЯ КОАГУЛОПАТИЯ
КЛАССИФИКАЦИЯ
1. Коагулопатия вследствие изолированного нарушения внутреннего механизма формирования протромбиназной активности (гемофилии А, В, С, б.Виллебранда, дефицит Хагемана)
2. Коагулопатия вследствие изолированного нарушения внешнего механизма формирования протромбиназной активности (гипопроконвертинемия – дефицит 7 ф.)
3. Комбинированное нарушение внешнего и внутреннего механизма формирования протромбиназной активности (парагемофилия – дефицит 5 ф., б.Стюарта-Прауэра – дефи-цит 10 ф.)
4. Нарушение конечной стадии свертывания крови (афибриногенемия)

СТАТИСТИКА
Среди всех форм коагулопатий страдают:
Гемофилией А 68 – 78%
Б. Виллебранда 9 – 18 %
Гемофилией В 6 – 13 %
Гемофилией С, парагемофилией и гипопроконвертинемией 1 – 2 %
Остальные формы – клиническая казуистика

Гемофилия А
Геморрагический диатез, обусловленный наслед-ственным дефицитом прокоагулянтной части фактора 8
Фактор 8 (высокомолекулярный белок)
1. Гликопротеин прокоагулянт (VIII:К)
2. Гликопротеин, осуществляющий адгезию тромбоцитов (VIII:ФВ)
3. Гликопротеин, активирующий адгезию тромбоцитов под влиянием ристомицина (VIII:Ркоф)
4. Антигенный маркер VIII:К (VIII:К АГ)
5. Антигенный маркер VIII: Ркоф (VIII: Ркоф АГ)
Активность VIII:К и VIII:ФВ снижается при уменьшении мультимерной структурыи всего 8 фактора

Гемофилия А
* Этиология – аномалия гена в Х-хромосоме, который контролирует синтез прокоагулянтной части ф. 8 (VIII:К)
** Болеют – мужчины (46, XhY)
** Виды
- Гемофилия А+ (антигенположительная форма – синтезируется аномальный VIII:К ), страдают 8 –10 %
- Гемофилия А- (антигенотрицательная форма – не синтезируется VIII:К ), страдают 90 –92 %
**** Клиника: кровоизлияния в большие суставы, гематомы (подкожные, внутримышечные), сильные и длительные посттравматические кровотечения. Возможны кровоизлия-ния в органы брюшной полости, желудочно-кишечные кровотечения


Гемофилия
Гемофилия

Гемофилия В
Этиология – аномалия гена в Х-хромосоме, который контролирует синтез ф. 9
Болеют – мужчины (46, XhY)
- женщины (46, XhXh), (45, Xh O)
*** Виды
- Гемофилия В+ (антигенположительная форма – синтезируется аномальный ф. 9 )
- Гемофилия В- (антигенотрицательная форма – не синтезируется ф. 9 )
Клиника: кровоизлияния в большие суставы, гематомы (подкожные, внутримышечные), сильные и длительные посттравматические кровотечения. Возможны кровоизлия-ния в органы брюшной полости, желудочно-кишечные кровотечения

ПРИОБРЕТЕННАЯ КОАГУЛОПАТИЯ
Особенность – полидефицитная
Етиология
1. Иммунная ингибиция прокоагулянтов (резус конфликт)
2. Дефицит вит. К–зависимых факторов коагуляции (7, 10, 9, 2)
а) нарушение синтеза в кишечнике (дисбактериоз, понос)
б) нарушение всасывания вит. К (дефицит желчи)
в) тяжелое повреждение печени
3. Передозировка гепарина

ГИПЕРКОАГУЛЯЦИЯ
ПОВЫШЕННАЯ СПОСОБНОСТЬ КРОВИ ОБРАЗОВЫВАТЬ СГУСТКИ В СОСУДАХ
ТРОМБОЗ
ДВС-СИНДРОМ

ДВС-СИНДРОМ (СИНДРОМ ДЕСИМИНОРОВАННОГО ВНУТРИСОСУДИСТОГО СВЕРТЫВАНИЯ КРОВИ)
КЛАССИФИКАЦИЯ
* По клиническому течению
1) острый (мгновенные формы характеризуются тяжелым течением)
2) хронический
* По распространенности
1) локализированный
2) генерализированный

ЭТИОЛОГИЯ
Инфекции, септические состояния
Шок (при септическом – смертность 100 %)
Хирургические вмешательства, ожеги
Все терминальные состояния, остановка сердца
Острый внутрисосудистый гемолиз
Акушерская патология (20-25 %)
Гемобластозы (при о. лейкозе – 33-45 %)
Деструктивные процессы в паренхиматозных органах
Аллергические реакции

Стадии ДВС-синдрома
1) Гиперкоагуляция (образование множественных тромбов вследствие активации системы коагуляции)
2) Коагулопатия потребления (истощение системы каогулянтов, чрезмерное использование тромбо-цитов для образования тромбов)
3) Гипокоагуляция (понижение активности коагу-лянтов, активация антикоагулянтов, активация фибринолиза)
4) Завершение (выздоровление, осложнения, смерть)

Патогенез ДВС-синдрома
1) Гипертромбинемия (тромбопластин поступает в кровь в большом количестве из поврежденных тканей и способ-ствует образованию тромбина). При инфекциях активированные моноциты-макрофаги синтези-руют собственные коагулянти (ф.7, ф.10, ф.9, ф.2)

Патогенез ДВС-синдрома
2) Массивная агрегация тромбоцитов (вызывает развитие тромбоцитопе-нии потребления и осложняется геморрагиями)
3) Травматизация и гемолиз эритро-цитов (при этом выделяется много АДФ, что усиливает адгезию и агрегацию тромбоцитов)

Патогенез ДВС-синдрома
4) “Гуморальный протеазный взрыв” (при активации прокоагулянтов, ан-тикоагулянтов, фибринолитиков, белков калликреин-кининовой си-стемы, системы комплемента в крови накапливается много продуктов бел-кового распада, которые являются очень токсическими и повреждают сосуды и ткани)

Патогенез ДВС-синдрома
5) Истощение системы фибрино-лиза
(способствует тромбообразованию)
6) Истощение факторов свертывания крови
(вызывают развитие геморрагий)

Клиника ДВС-синдрома
1. Гемокоагуляционный шок
причина
* нарушения микроциркуляции (вызывают развитие гипоксии тканей)
* накопление токсических продуктов протеолиза
проявления
* понижение артериального давления
* понижение центрального венозного давления
* кровотечения (провоцируют геморрагический шок)

Клиника ДВС-синдрома
2. Нарушения гемостаза
а) гиперкоагуляция
Главное проявление – тромбоз
Кровь сворачивается в пробирке
б) гипокоагуляция
Главное проявление – кровотечения
(одновременно истощается система фибринолиза)

Клиника ДВС-синдрома
3. Тромбоцитопения
Возникает вследствие образова-ния большого количества тромбов в сосудах (тромбоцитопения потребления)

